
【题目】某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:

已知:Cu(NO3)2·3H2O ![]() Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 ![]() CuO
CuO
SOCl2熔点―105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(1)第②步调pH适合的物质是_________(填化学式)。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_____________。为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是___________(填一种)。
(3)第④步中发生反应的化学方程式是_______________________。
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图)有一处不合理,请提出改进方案并说明理由___________________。

装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞______(填“a”、“b”或“a和b”)。
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。
【答案】 CuO或Cu(OH)2或Cu2(OH)2CO3 将溶液转移至蒸发皿中,控制温度(不高于170℃,防止硝酸铜水解),加热至溶液表面形成一层晶膜 减慢冷却结晶的速度或冷却后静置较长时间 Cu(NO3)23H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCl↑ 在AB之间增加干燥装置,防止B中的水蒸气进入A中 b 92.5%
【解析】为提高铜的浸取率,所用硝酸必然是过量的,此时铁也溶解转化为硝酸铁,调pH的目的是除去铁离子。然后蒸发浓缩、降温结晶得到硝酸铜晶体,最后在SOCl2的保护下脱去结晶水得到无水硝酸铜,据此解答。
(1)调节pH促进铁离子水解沉淀铁离子,不引入新杂质,同时不能沉淀铜离子,因此第②步调pH适合的物质是CuO或Cu(OH)2或Cu2(OH)2CO3;
(2)根据题意,温度不能高于170℃,否则Cu(NO3)23H2O变质,故蒸发浓缩应将溶液转移至蒸发皿中,控制温度(不高于170℃),加热至溶液表面形成一层晶膜减慢冷却结晶的速度,可得到较大颗粒的Cu(NO3)23H2O晶体;
(3)根据以上分析可知第④步中发生反应的化学方程式是Cu(NO3)23H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCl↑;
(4)第④步,某同学设计的实验装置有一处不合理,根据装置图可知应该是氢氧化钠溶液中的水蒸气可以进入A中影响A中的硝酸铜晶体脱水反应。改进的方法是在AB之间增加干燥装置,理由是防止B中的水蒸气进入A中;装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞b。
(5)由图像可知,A=0.620时,对应的溶液中c(Cu2+)=1.55×10-3mol/L,则n[Cu(NO3)2]=100mL/10mL×0.1L×1.55×10-3mol/L=1.55×10-3mol,则无水Cu(NO3)2产品的纯度是1.55×10-3×188/0.3150×100%=92.5%。


 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量的十萘奈置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是______________________________________________________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。
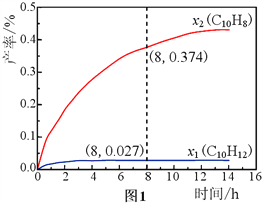

①在8 h时,反应体系内氢气的量为__________mol(忽略其他副反应)。
②x1显著低于x2的原因是________________________________________。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图。
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
(4)电极反应式:________________________________和2Fe+3H2O+N2=Fe2O3+2NH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. ![]() C表示质子数为6、中子数为8的核素
C表示质子数为6、中子数为8的核素
B. 甲醇(CH3OH)和甘油(CH2OHCHOHCH2OH)互为同系物
C. C5H12的同分异构体有3种,其沸点各不相同
D. CH3CH2CH2CH(CH3)2的名称是2甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还取性:SO32->I-。向含有a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
A. 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl-
B. 当 5a=4b时,发生的离子反应为 4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C. 当 a≤b≤![]() 时,反应中转移电子的物质的量n(e-)为 a mol≤n(e-)≤3a mol
时,反应中转移电子的物质的量n(e-)为 a mol≤n(e-)≤3a mol
D. 当a<b<![]() 时,溶液中SO42-、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b
时,溶液中SO42-、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )

A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O能否反应产生Cl2。
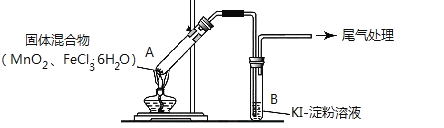
实验操作和现象如下表:
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
(1)实验1和实验2产生白雾的原因是___________________________。
(2)实验2说明黄色气体中含有___________(填化学式)则实验1中③的现象也可能是发生了另一个离子反应,则其离子方程式为______________________________。
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B 间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中淀粉KI溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+。
则方案1中C中盛放的试剂是_________________;方案2中检验 Fe2+的试剂名称是____________,选择NaBr溶液的依据是__________________。
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________。请你设计实验方案验证此猜想__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
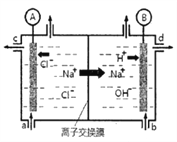
完成下列填空:
①离子交换膜的作用为:____________________。
②写出电解饱和食盐水的离子方程式_________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
⑵电化学在日常生活中用途广泛,图①是镁次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,图②是Cr2O![]() 的工业废水的处理,下列说法正确的是(____)
的工业废水的处理,下列说法正确的是(____)
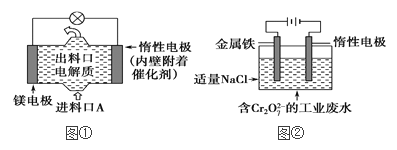
A.图②中Cr2O![]() 离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生
C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2
D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀
⑶观察下列装置,回答下列问题:
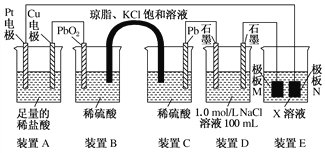
①装置B中PbO2上发生的电极反应方程式为_____________________________________。
②装置A中总反应的离子方程式为_____________________________________________。
③当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为________ L(标准状况下,不考虑气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
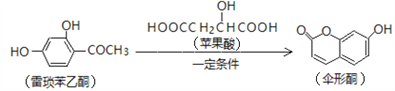
下列说法中正确的是
A. 1mol雷琐苯乙酮最多能与3mol Br2发生取代反应
B. 苹果酸能形成一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com