
将13.0g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体6.72L(标况)。另取等质量的合金溶于过量的稀硝酸中生成6.72L(标况)NO,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量是
A.11.85g B.12.7g C.27.45 g D.28.3g
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
强热条件下,硫酸亚铁固体发生分解:2FeSO4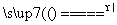 Fe2O3+SO2↑+SO3↑,如将此反应生成的气体通入BaCl2溶液中,则( )
Fe2O3+SO2↑+SO3↑,如将此反应生成的气体通入BaCl2溶液中,则( )
①析出BaSO3沉淀 ②析出BaSO4沉淀 ③逸出SO3气体 ④逸出SO2气体
A.①② B.①④ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
关于浓度均为0.1 mol·L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH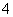 ):③>① B.水电离出的c(H+):②>①
):③>① B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH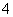 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.检验溶液中是否含有SO32-时,用HNO3酸化后再加BaCl2溶液
B.为提高KMnO4溶液的氧化能力,用盐酸酸化KMnO4溶液
C.检验某溶液是否含有Fe3+时,用HNO3酸化后,加KSCN溶液
D.检验溶液中是否含有SO42-时,用HCl酸化后,加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
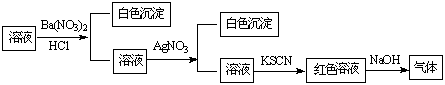
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
|
|
|
|
等)生产Ni2O3。其工艺流程为:
 |

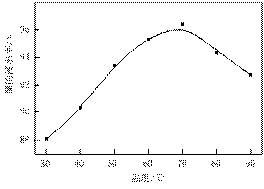
图Ⅰ 图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为
。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
⑵工艺流程中“副产品”的化学式为 。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。该实验方案合理吗?若合理,请说明理由;若不合理,请加以改正。__________________________________________。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度
为 mol·L-1(常温时CaF2的溶度积常数为2.7×10-11)。抽滤装置中除了抽气泵、
安全瓶外,还需要的主要仪器有_____________________。
⑸电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、钴、镍的原子序数分别为26、27、28他们性质相似,被称为铁系元素,已知反应:①Fe2O3+6HCl=2FeCl3+3H2O②Co2O3+6HCl=2CoCl2+Cl2+3H2O,氧化能力由强到弱的顺序
A.Fe2O3>Co2O3>Cl2 B.Cl2>Fe2O3>Co2O3
C.Cl2>Co2O3>Fe2O3 D.Co2O3>Cl2>Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是
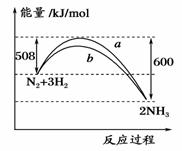
A.加入催化剂,不能改变该化学反应的反应热
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g),ΔH=-92 kJ/mol
D.在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com