

 (或
(或
 );
);分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小;非金属性越强,最高价氧化物水化物的酸性越强;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等;
(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,注明聚集状态、反应热书写热化学方程式;
(5)①R是NH4Al(SO4)2,溶液中Al3+、NH4+均水解使溶液呈酸性,但Al3+比 NH4+水解程度更大;
②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O;
③根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,故答案为:第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4,
故答案为:r(O2-)>r(Na+);HClO4;H2SO4;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为: (或
(或
 ),
),
故答案为: (或
(或
 );
);
(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,则该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1,
故答案为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1;
(5)①R是NH4Al(SO4)2,溶液中Al3+、NH4+均水解使溶液呈酸性,但Al3+比 NH4+水解程度更大,故离子浓度由大到小的顺序是:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-),
故答案为:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-);
②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
③10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
点评 本题考查结构位置性质关系、离子半径的大小比较、元素周期律、热化学方程式书写、离子浓度大小比较、化学图象及化学计算,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该烃的分子式为C2H2 | B. | 该反应为复分解反应 | ||
| C. | 该铝的碳化物为Al2C6 | D. | 该反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 珍珠上的污渍可以用酒精擦除,并用软布擦干后用脱脂棉包好保存 | |
| B. | 珊瑚、玛瑙和珍珠一样都可以作为重要药材 | |
| C. | 红宝石可以用于激光器,还可用于制作红宝石轴承 | |
| D. | 蓝宝石中含有变价元素铁、钛等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象或事实 | 解释 | |
| A | 少量NaCl固体完全溶于水得不饱和溶液 | 开始固体溶解和溶质回到固体表面两过程前者速率较大,最后两过程仍同时存在但速率相等 |
| B | CuCl2溶液接通直流电源可导电 | 电解CuCl2溶液: 电子经过负极→阴扱→阳极→正极→电解液 |
| C | 在AgCl沉淀中滴加NaI溶液.得到黄色AgCl沉淀 | 溶解度小的沉淀易向溶解度更小的沉淀抟化 |
| D | Mg(OH)2沉淀溶于呈中性的醋酸铵溶液 | 醋酸铵溶液水解呈酸性H-将Mg(OH)2沉淀溶解 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 质量 物质 | 实验前 | 实验后 |
| 甲的质量/g | 101.1 | l03.0 |
| 乙的质量/g | 82.0 | 86.4 |


 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 操作 | 现象 |
| I | 向2mL 1mol•L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
| 1Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色. |
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| III | 向1mol•L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
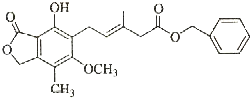
| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以催化加氢,1mol该物质最多可与7mol H2反应 | |
| D. | 该化合物有4种官能团,可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com