

分析 (1)浓硫酸具有脱水性,则酸溶过程中,硫酸的作用是浓硫酸会使木屑炭化;吸收完成后,将吸收液蒸发浓缩、冷却结晶、过滤、洗涤即可得到晶体;
(2)硝酸易分解,则A装置须控制反应液的温度不高于60℃的原因是温度过高会导致硝酸的分解;反应中产生的NO2、NO被碳酸钠溶液吸收即转化为亚硝酸钠;
(3)NO和NO2的物质的量比=1:1时恰好可以看作亚硝酸,因此若(NO):n(NO2)>1:1,则会导致排放气体中NO含量升高;若n(NO):n(NO2)<1:1时NO2过量,则又会产生硝酸钠;
(4)已知NaNO2能把酸性条件下的Fe2+氧化,说明氮元素的化合价降低,同时产生一种有毒的气体,因此该气体是NO;
(5)由于NaNO2有还原性,能使酸性KMnO4溶液褪色,所以可以通过氧化还原滴定测定其纯度.
解答 解:(1)浓硫酸具有脱水性,则酸溶过程中,硫酸的作用是浓硫酸会使木屑炭化;吸收完成后,将吸收液蒸发浓缩、冷却结晶、过滤、洗涤即可得到白色晶状的亚硝酸钠,故答案为:浓硫酸会使木屑炭化;冷却结晶;过滤;
(2)硝酸易分解,则A装置须控制反应液的温度不高于60℃的原因是温度过高会导致硝酸的分解,使NaNO2产率降低;反应中产生的NO2、NO被碳酸钠溶液吸收即转化为亚硝酸钠,故答案为:温度过高会导致硝酸的分解,使NaNO2产率降低;b;
(3)NO和NO2的物质的量比=1:1时恰好可以看作亚硝酸,因此若(NO):n(NO2)>1:1,则会导致排放气体中NO含量升高;若n(NO):n(NO2)<1:1时NO2过量,则又会产生硝酸钠,即会使产品中混有的杂质为NaNO3,
故答案为:排放气体中NO含量升高;NaNO3;
(4)已知NaNO2能把酸性条件下的Fe2+氧化,说明氮元素的化合价降低,同时产生一种有毒的气体,因此该气体是NO,所以该反应的离子方程式为NO2-+2H++Fe2+=NO↑+Fe3++H2O,故答案为:NO2-+2H++Fe2+=NO↑+Fe3++H2O;
(5)由于NaNO2有还原性,能使酸性KMnO4溶液褪色,所以可以通过氧化还原滴定测定其纯度,因此实验方案设计为:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,然后用c3mol•L-1酸性KMnO4溶液滴定至溶液由无色恰好变为浅红色,且半分钟内不褪色,读数,重复以上操作2~3次,
故答案为:然后用c3mol•L-1酸性KMnO4溶液滴定至溶液由无色恰好变为浅红色,且半分钟内不褪色,读数,重复以上操作2~3次.
点评 本题考查物质制备实验方案设计与探究,为高频考点,把握制备原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用化学反应可实现12C到14C的转化 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 大量使用燃煤发电是形成雾霾的主要原因 | |
| D. | 晶体硅可用作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
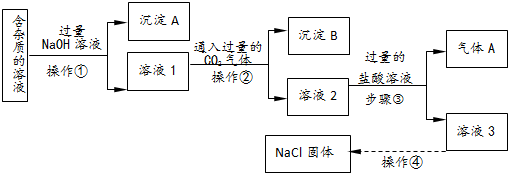
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 棕红色NO2加压后颜色先变深后变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往某溶液中滴加BaCl2溶液,产生白色沉淀,则原溶液中一定含SO42- | |
| B. | 往某溶液中滴加稀硝酸酸化的硝酸银溶液,产生白色沉淀,则原溶液中一定含Cl- | |
| C. | 取某溶液进行焰色反应,透过蓝色钴玻璃焰色为紫色,则原溶液的溶质一定是钾盐 | |
| D. | 往某溶液中通入CO2,产生白色沉淀,则原溶液中一定含SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
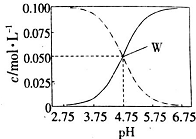 室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )
室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )| A. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO)>c(H+)+c(OH-) | |
| B. | 向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l | |
| D. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com