
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 物质发生化学反应都伴随着能量变化 |
分析 A.物理变化中可能存在能量变化;
B.吸热反应不一定需要加热;
C.放热反应有的也需要加热才能发生;
D.化学反应实质是旧化学键断裂和新化学键的形成.
解答 解:A.物理变化时也可能伴随能量变化,如气态水液化会放出热量,所以伴有能量变化的物质变化不一定是化学变化,故A错误;
B.吸热反应不一定需要加热,如氢氧化钡晶体与氯化铵晶体搅拌即可发生反应,不需要加热,故B错误;
C.放热反应有的也需要加热才能发生,如碳在空气中的燃烧需要加热,故C错误;
D.化学反应实质是反应物化学键断裂化学键吸收能量,生成物形成化学键放出热量,物质发生化学反应过程中一定伴随能量变化,故D正确.
故选D.
点评 本题考查了化学反应过程中的能量变化知识,注意常见的吸热以及放热反应是解题的关键,注意把握反应的热效应与反应条件的关系,难度不大.


科目:高中化学 来源: 题型:解答题
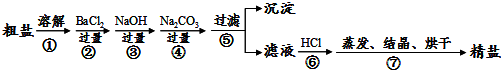
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
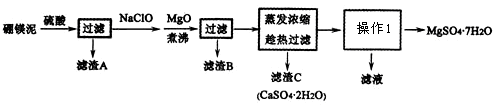
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
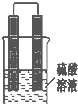 甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•
甲同学想利用原电池反应检测金属的活动性顺序,他使用镁片与铝片作电极,放入 稀H2SO4溶液中,如图所示•查看答案和解析>>
科目:高中化学 来源: 题型:解答题
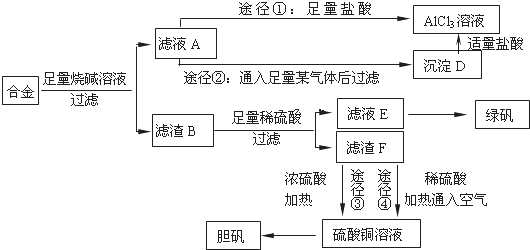
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
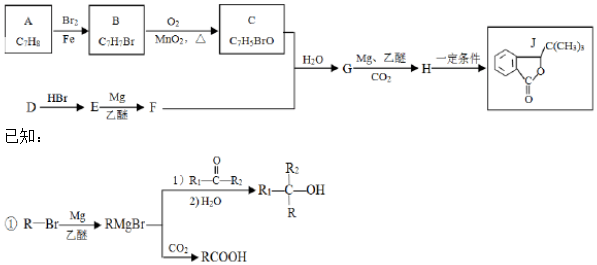
 .
. (写结构简式).
(写结构简式).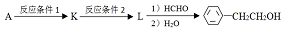
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com