
(12分)酸浸法制取硫酸铜的流程示意图如下

(1)步骤①中Cu2(OH)2CO3 发生反应的化学方程式为 。
(2)在步骤③发生的反应中,1mol MnO2转移2mol 电子,该反应的离子方程式为 。
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取4.800 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
b.量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定
(反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
c.量取25.00 mL溶液A,加入足量的NaOH溶液充分反应后,过滤、洗涤、灼烧得红色粉末0.600g。
d.另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165 g。
①用Na2S2O3溶液进行滴定时,滴定到终点的颜色变化为 。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。
(共12分)
(1)Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O
(2)MnO2+2Fe2++4H+====Mn2++2Fe3++2H2O
(3)① 滴入最后一滴Na2S2O3溶液时,溶液蓝色恰好褪去,且半分钟内不再恢复到原来颜色
②n(Fe3+)=2n(I2) =n(Na2S2O3)=0.2500 mol·L-1×30.00 mL×10-3 L·mL-1=7.50×10-3 mol
n(Fe3+)=2(Fe2O3)=2×0.600g/160g·mol-1=7.50×10-3 mol
n(SO42-)=1.165 g ÷233 g·mol-1=5.00×10-3 mol
100 mL溶液中含有n(Fe3+)=0.03 mol,n(SO42-)=0.02 mol (2分)
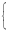 4.800-0.03×56-0.02×96=n(NH4+)×18+n(OH-)×17
4.800-0.03×56-0.02×96=n(NH4+)×18+n(OH-)×17
0.03×3+ n(NH4+)=2×0.02+n(OH-)
n(NH4+)=0.01 mol,n(OH-)=0.06 mol (2分)
x∶y∶m∶n=n(NH4+)∶n(Fe3+)∶n(SO42-)∶n(OH-)=1∶3∶2∶6
化学式为NH4Fe3(SO4)2(OH)6 (2分)
【解析】
试题分析:(1)步骤①中Cu2(OH)2CO3 与硫酸反应生成硫酸铜、水、二氧化碳,化学方程式为Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O;
(2)在步骤③发生的反应中,二氧化锰与亚铁离子发生氧化还原反应,1mol MnO2转移2mol 电子,则Mn元素的化合价降低2价,生成锰离子,Fe元素的化合价升高到+3价,则离子方程式为MnO2+2Fe2++4H+====Mn2++2Fe3++2H2O;
(3)①碘使淀粉变蓝色,所以开始溶液为蓝色,滴入Na2S2O3溶液,溶液的蓝色逐渐褪去,滴入最后一滴Na2S2O3溶液时,溶液蓝色恰好褪去,且半分钟内不再恢复到原来颜色;
②加入足量的KI则铁离子与碘离子反应生成碘单质,再与Na2S2O3溶液发生氧化还原反应,所以2 Fe3+ ~I2~2Na2S2O3,则n(Fe3+)=2n(I2) =n(Na2S2O3)=0.2500 mol·L-1×30.00 mL×10-3 L·mL-1=7.50×10-3 mol;红色粉末为氧化铁,则n(Fe3+)=2(Fe2O3)=2×0.600g/160g·mol-1=7.50×10-3 mol;与氯化钡溶液反应产生硫酸钡沉淀,则n(SO42-)=1.165 g ÷233 g·mol-1=5.00×10-3 mol;
则100 mL溶液中含有n(Fe3+)= 7.50×10-3mol×4= 0.03 mol,n(SO42-)= 5.00×10-3 mol×4= 0.02 mol ,根据质量守恒和正负化合价代数和为0,得
4.800-0.03×56-0.02×96=n(NH4+)×18+n(OH-)×17
0.03×3+ n(NH4+)=2×0.02+n(OH-)
解得 n(NH4+)=0.01 mol,n(OH-)=0.06 mol
x∶y∶m∶n=n(NH4+)∶n(Fe3+)∶n(SO42-)∶n(OH-)=1∶3∶2∶6
化学式为NH4Fe3(SO4)2(OH)6 。
考点:考查对流程的分析,方程式的书写,物质化学式的计算


科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
下列解释事实的离子方程式不正确的是
A.酸性KMnO4溶液与H2O2反应:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2O
B.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:填空题
(10分)在容积为1 L的密闭容器中,进行如下反应:
A(g)+2B(g)  C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。

请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算在800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关 的说法中正确的是
的说法中正确的是
A.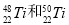 原子中均含有22个中子
原子中均含有22个中子
B. 为同一核素
为同一核素
C.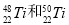 互称同位素,在周期表中位置相同,都在第4纵行
互称同位素,在周期表中位置相同,都在第4纵行
D.分别由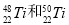 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
2012年3月新修订的《环境空气质量标准》增设了PM 2.5(直径小于或等于2.5微米的颗粒物)浓度限值、臭氧8小时平均浓度限值。下列有关说法正确的是
A.PM 2.5所指颗粒物大小与胶体中分散质粒子大小相当
B.O2和O3互为同素异形体,两者的化学性质相同
C.O3转化为O2和O2转化为O3过程中均有能量变化
D.反应3O2=2O3有单质参加,属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三12月学情调研化学试卷(解析版) 题型:选择题
在探究氨水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氨水有刺激性气味,说明氨水中含有氨分子。
B.向氨水中滴加酚酞试剂,溶液变红,说明氨水中含有OH-
C.向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH4+
D.浓氨水和浓盐酸靠近产生大量白烟,说明氨气与氯化氢容易反应。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三12月学情调研化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确是
A.标准状况下,2.24 L三氯甲烷中含有碳氯共价健的数目为0.3NA
B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
C.常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA
D.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省常州市高三上学期期末化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A.图1表示盐酸滴加到0.1 mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂。
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂。
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g) CH3OH(g),该反应的ΔH=-91kJ/mol。
CH3OH(g),该反应的ΔH=-91kJ/mol。
D.图4表示物质的量之比为2∶3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com