
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算氢氧根离子的物质的量,根据摩尔质量以g/mol为单位,数值等于其相对分子质量;
(2)根据n=$\frac{m}{M}$计算二氧化碳物质的量,再根据V=nVm计算其体积;1mol的二氧化碳含有22mol的电子;
(3)K2R中含0.4mol K+,则K2R的物质的量为0.2mol,根据M=$\frac{m}{n}$计算K2R的摩尔质量,进而计算R的相对原子质量;根据n=$\frac{m}{M}$计算R原子物质的量,K2R的物质的量与R原子物质的量相等;
(4)假设质量都为1g,根据n=$\frac{m}{M}$计算CO和CO2的物质的量,同温同压下,气体体积之比等于其物质的量之比;同温同体积下等质量的CO和CO2,压强之比等于其物质的量之比.
解答 解:(1)6.02×1023个氢氧根离子的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}}$=1mol,氢氧根离子的相对式质量为16+1=17,其摩尔质量为17g/mol,
故答案为:1;17 g/mol;
(2)22g CO2的物质的量为$\frac{22g}{44g/mol}$=0.5mol,分子数为:0.5NA,标况下,二氧化碳体积是0.5mol×22.4L/mol=11.2L;所含的电子的物质的量为11mol,故答案为:0.5NA;11.2L;11;
(3)22.0g K2R中含0.4mol K+,则K2R的物质的量为$\frac{0.4mol}{2}$=0.2mol,故K2R的摩尔质量为$\frac{22.0g}{0.2mol}$=110g/mol,R的相对原子质量为110-39×2=32;1.6g R原子物质的量为$\frac{1.6g}{32g/mol}$=0.05mol,n(K2R)=n(R)=0.05mol,
故答案为:110g/mol;32;0.05mol;
(4)假设质量都为1g,则CO的物质的量为$\frac{1}{28}$mol、CO2的物质的量为$\frac{1}{44}$mol,同温同压下,气体体积之比等于其物质的量之比,CO和CO2的体积之比=$\frac{1}{28}$mol:$\frac{1}{44}$mol=11:7;同温同压下等质量的CO和CO2,体积之比为 11:7,同温同体积下等质量的CO和CO2,压强之比为11:7,故答案为:11:7;11:7.
点评 本题考查物质的量有关计算,难度不大,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 六水氯化钙属于混合物 | B. | 葡萄糖注射液不能产生丁达尔效应 | ||
| C. | 食盐水属于浊液 | D. | 氯化铵不属于盐类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
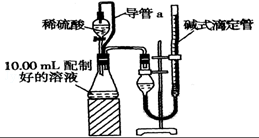 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极,被氧化 | B. | 负极,被还原 | C. | 正极,被还原 | D. | 正极,被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
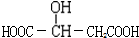 ,下列有关这种有机物的说法不正确的是( )
,下列有关这种有机物的说法不正确的是( )| A. | 苹果酸的分子式为C4H6O5 | |
| B. | 1mol苹果酸能与足量金属钠反应,能生成标准状况下的氢气22.4L | |
| C. | 1mol苹果酸能与足量碳酸氢钠溶液反应,能生成标准状况下的二氧化碳气体44.8L | |
| D. | 苹果酸在一定条件下与乙醇、乙酸均能发生酯化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com