
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:

活性炭的作用是_______;O3消毒的优点是_______。
【答案】AD 加成反应 2ClO2+2CN-=2CO2+N2+2Cl- 产物为无毒无害的Cl-、CO2和N2 吸附水中的有机物(或除去水中的异味) 反应产物无毒无害
【解析】
(1)把握“原料分子中的原子全转变为所需产物”或“不产生副产物,实现零排放”,然后根据题给各选项观察反应物中所有原子是否都转化成了所需产物,据此判断反应类型的特点;
(2)先根据题意先确定反应产物:应将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-,Cl元素由+4→-1价,C元素由+2→+4,N元素由-3→0价,然后再利用化合价升降法配平化学方程式;
(3)根据流程图天然水![]() 去除水中不溶性杂质
去除水中不溶性杂质![]() 通过吸附作用去除有毒、有异味的分子
通过吸附作用去除有毒、有异味的分子![]() 去除水中的阳离子
去除水中的阳离子![]() 去除水中的阴离子
去除水中的阴离子![]() 杀菌消毒来解答;
杀菌消毒来解答;
(1)A. CH2=CH2+HCl→CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,A符合同一;
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O中除目标产物CH3CH2Cl外,还有水生成,原子利用率不是100%,B不符合题意;
CH3CH2Cl+H2O中除目标产物CH3CH2Cl外,还有水生成,原子利用率不是100%,B不符合题意;
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl中除目标产物CH3CH2Cl外,还有HCl生成,原子利用率不是100%,C不符合题意;
CH3CH2Cl+HCl中除目标产物CH3CH2Cl外,还有HCl生成,原子利用率不是100%,C不符合题意;
D.CH2=CHCl+H2![]() CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,D符合同一;
CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,D符合同一;
由上述四个反应可归纳出,原子经济性高的是加成反应;
(2)ClO2具有强氧化性,可以将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子反应为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-,其优点为产物都是无毒的气体(CO2和N2),不污染环境;
(3)根据流程图天然水![]() 去除水中不溶性杂质
去除水中不溶性杂质![]() 通过吸附作用去除有毒、有异味的分子
通过吸附作用去除有毒、有异味的分子![]() 去除水中的阳离子
去除水中的阳离子![]() 去除水中的阴离子
去除水中的阴离子![]() 杀菌消毒,所以活性炭的作用为吸附水中的有机物(或去除水中的异味),O3消毒的优点是反应产物是H2O,产物无毒、无害。
杀菌消毒,所以活性炭的作用为吸附水中的有机物(或去除水中的异味),O3消毒的优点是反应产物是H2O,产物无毒、无害。


科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y![]() 2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是

①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示的装置做有关CO2气体的实验:

⑴甲同学将收集满CO2气体的试管倒插入紫色石蕊试液中(左图),并轻轻振荡试管。
①描述产生的现象:____________________________________________。
②写出反应的化学方程式:____________________________________________。
⑵乙同学挤压图装置中滴管的胶头,使其中的NaOH溶液滴入烧瓶,并轻轻振荡,系在导气管一端的气球慢慢胀大。产生这一现象的原因是________________________(请用离子方程式结合必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是__,证明不含单质铝的现象是__。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3 mol·L-1NaOH、3mol·L-1HCl、3mol·L-1HNO3、3mol·L-1CuSO4、0.01mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图,
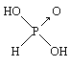
是具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式____。亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为____。
(2)某温度下,0.1mol/L的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2mol/L该温度下H3PO3的一级电离平衡常数![]() =____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:
=____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:![]() ____
____![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空, 5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程如图:

已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有________、_______(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:____________。
(2)过滤所得滤渣I的主要成分为________(填化学式)。
(3)该流程中可循环利用的物质是____________________;滤渣Ⅱ与浓硫酸发生反应的化学方程式为__________________________________________________;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指____________________ 过滤、洗涤、干燥。
(4) “分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为_____________;“还原”过程可以用金属镁制备金属铍的原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是( )
密闭容器体积/L | 甲 | 乙 | 丙 | 丁 | |
2 | 2 | 2 | 1 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
A.甲中反应的平衡常数小于乙
B.该温度下,甲和乙中反应的平衡常数K均为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙>甲=丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.68g铜与50mL一定浓度的硝酸恰好完全反应,收集到标准状况下4.48L气体。
请回答:
(1)NO的体积为__L,NO2的体积为__L;
(2)被还原的硝酸的物质的量是__mol;
(3)硝酸的物质的量浓度是__mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com