
| A. | 等于23% | B. | 大于23% | C. | 等于40% | D. | 大于40% |
分析 钠投入到水中,发生根据反应的化学方程式分析生成NaOH的质量和溶液的质量,进而计算溶质的质量分数.
解答 解:由于钠是活泼金属能与水发生2Na+2H2O=2NaOH+H2↑的反应,所以反应后生成的溶质设23克金属钠与水反应生成氢氧化钠的质量为X,生成氢气质量为Y:
2Na+2H2O═2NaOH+H2↑
46 36 80 2
23g 18 x y
$\frac{46}{23}=\frac{80}{x}=\frac{2}{y}$,解得x=40g;y=1g,
反应后所得溶液的质量分数:$\frac{40}{23+77-1}×100%$,该值一定大于40%.
故选D.
点评 通过回答本题知道了有的物质放入水中溶质会发生改变,此时的溶质的质量要根据方程式算出再进行计算.


科目:高中化学 来源: 题型:选择题
| A. |  制取纯净氢氧化亚铁 | B. | 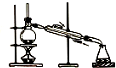 石油的蒸馏 | ||
| C. | 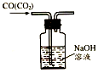 除去CO气体中的CO2气体 | D. | 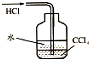 吸收HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:3 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
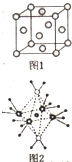 X、Y、Z、R、M、Q为前四周期元素,且原子序数依次增大,YZ2是红棕色气体;X与Y元素可形成YX3;R+与Z2-具有相同的核外电子排布;M-的M层电子数是K层上电子的4倍;Q2+离子的3d轨道中有9个电子.
X、Y、Z、R、M、Q为前四周期元素,且原子序数依次增大,YZ2是红棕色气体;X与Y元素可形成YX3;R+与Z2-具有相同的核外电子排布;M-的M层电子数是K层上电子的4倍;Q2+离子的3d轨道中有9个电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com