
 ,Z的化学式SiO2;
,Z的化学式SiO2;分析 A、B、C、D均为短周期元素,原子序数依次增大;①A与D同主族,A形成的氢化物分子M与D形成的氢化物分子N都含有18个电子,则A为O元素、N为S元素,M为H2O2、D为H2S;
②一定条件下,A、D分别和B形成的化合物X和Y具有相同的摩尔质量,且焰色反应均呈黄色,则B为Na,X为Na2O2、Y为Na2S;
③A和C形成的化合物Z是光导纤维的主要原料,则C为Si,Z为SiO2,据此解答.
解答 解:A、B、C、D均为短周期元素,原子序数依次增大;
①A与D同主族,A形成的氢化物分子M与D形成的氢化物分子N都含有18个电子,则A为O元素、D为S元素,M为H2O2、N为H2S;
②一定条件下,A、D分别和B形成的化合物X和Y具有相同的摩尔质量,且焰色反应均呈黄色,则B为Na,X为Na2O2、Y为Na2S;
③A和C形成的化合物Z是光导纤维的主要原料,则C为Si,Z为SiO2;
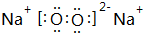
(1)X为Na2O2,电子式为 ,Z的化学式为SiO2,
,Z的化学式为SiO2,
故答案为: ;SiO2;
;SiO2;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Si>S>O,故答案为:Na>Si>S>O;
(3)在H2O2的溶液中通入H2S,反应生成硫与水,反应方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O.
点评 本题考查元素化合物推断,注意根据焰色反应及18电子进行推断,熟练掌握中学常见10电子、18电子微粒.


科目:高中化学 来源: 题型:选择题
| A. | 90℃时,纯水的pH等于7 | |
| B. | 配制FeCl3溶液,为了抑制水解,常加稀硫酸 | |
| C. | 已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致 | |
| D. | 在Na2S溶液中,离子浓度的关系是:c (Na+)>c (S2-)>c (HS-)>c (OH-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
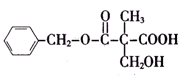
| A. | A不能和新制Cu(OH)2悬浊液反应 | |
| B. | A中含有2种含氧官能团 | |
| C. | A能够发生加成、取代和消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 解释或实验结论 |
| (1)纯净的A为无色粘稠液体, 易溶于水,沸点为380.4℃ | (1)将A从它的水溶液里分离出来 的操作方法是蒸馏. |
| (2)将13.6gA在20.0L纯O2(过量)中充分燃烧 并使反应后的气体依次缓缓通过浓硫酸和碱石灰后, 测得气体体积分别为17.76L和6.56L (所有气体体积均在标准状况下测定). | (2)A的实验式为C5H12O4, A的分子式为C5H12O4. |
(3)A的核磁共振氢谱如图: | (3)A中含有2种氢原 子,A的键线式为 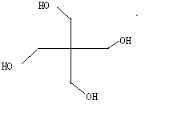 . . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
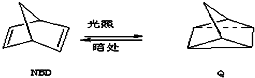 △H=+88.62kJ/mol
△H=+88.62kJ/mol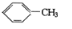 .若用氘(D)原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.
.若用氘(D)原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.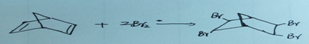 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 甲、乙氢氧化物溶液的碱性:甲>乙 | |
| C. | 乙能与盐酸反应放出H2,而甲不能 | |
| D. | 将甲、乙作电极组成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变时增大压强,能使全气体反应体系中活化分子百分数增加 | |
| B. | 中和反应都是放热反应 | |
| C. | 在FeCl3溶液和KSCN溶液反应的平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | 熵增大的反应不一定自发,但自发反应熵定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4在负极发生氧化反应 | |
| B. | 工作一段时间后,电解质溶液中KOH的物质的量减少 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 该电池工作时,X极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
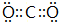 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com