
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法正确的是
N2(g)+2CO2(g)。下列说法正确的是
A.升高温度可使该反应的逆反应速率降低
B.达到化学平衡时,化学反应已经停止
C.v正(NO)=v正(CO2)时,说明达到了化学平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )。

A. 图①:验证H2CO3酸性强于H2SiO3 B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5 D. 图④:分离C2H5OH与CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol·L1,下列说法错误的是
A. Na2CO3溶液加水稀释后,溶液中c(HCO3)/c(CO32)的值增大
B. 将③、④等体积混合所得溶液中:2c(OH)2c(H+)=3c(H2CO3)+2c(HCO3)c(CO32)
C. 向溶液①、②中分别滴加25mL0.1mol·L1盐酸后,溶液中c(NH4+):①<②
D. 将溶液①、②等体积混合所得溶液呈碱性且:c(NH4+)>c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3达到平衡状态
2NH3达到平衡状态
A.1个N≡N键形成的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】425℃时,在两个1L密闭容器中分别发生化学反应,物质的浓度随时间的变化如图所示。下列叙述错误的是( )

A.图①中t0时,三种物质的物质的量相等
B.图①中![]() 时,反应达到平衡状态
时,反应达到平衡状态
C.图②中的可逆反应为2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
D.图①②中,当c(HI)=3.16mol/L时,两容器中的反应均达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
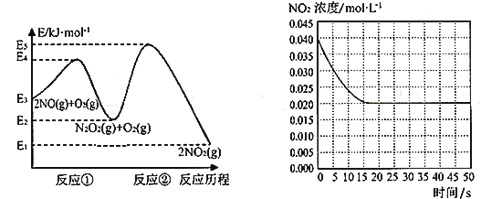
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______;该温度下反应2NO+O2![]() 2NO2的化学平衡常数K为_____。
2NO2的化学平衡常数K为_____。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____(填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________。
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____。
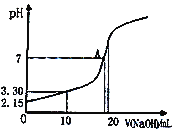
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
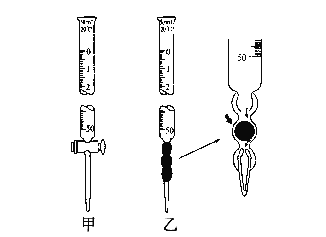
(1).滴定管如图所示,用______滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
(2).用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该实验中用去标准液的体积为________ml。
(3).下列操作会使所测得的盐酸的浓度偏低的是________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(4).滴定过程中,眼睛应注视________;在铁架台上垫一张白纸,其目的是_______________;
若用酚酞作指示剂,则判断达到滴定终点时的现象是__________________。
(5).根据上表数据,计算被测盐酸的物质的量浓度是________mol/L。(小数点后保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )
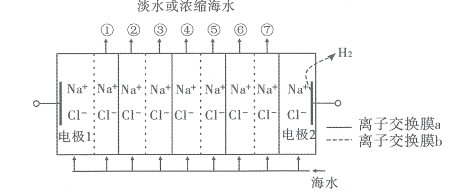
A. 离子交换膜b为阳离子交换膜
B. 各间隔室的排出液中,①③⑤⑦为淡水
C. 通电时,电极l附近溶液的pH比电极2附近溶液的pH变化明显
D. 淡化过程中,得到的浓缩海水没有任何使用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的硬度常用一种规定的标准来衡量:将水中的Ca2+、Mg2+都看作Ca2+,并将其质量折算成CaO的质量,通常把1L水中含有10mgCaO称为1°,1L水中含有20mgCaO即为2°,以此类推,8°以上为硬水,8°以下为软水,Ca2+、Mg2+的硬度之和称为总硬度。用配位滴定法分析某水样(含有Ca2+、Mg2+、Fe3+、Cl-、SO42-、HCO3-)的硬度时,取50.00mL水样放入250mL锥形瓶中,加入稀盐酸数滴,煮沸,冷却,加入2mL1∶1的三乙醇胺溶液和10mLNH3·H2O—NH4Cl缓冲溶液(pH=10)及3滴酸性铬蓝K素酚绿B混合指示剂,用0.01000mol·L-1 EDTA溶液滴定至由红色到蓝色即终点,消耗EDTA溶液12.5mL。另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的NaOH溶液使pH>12,用0.01000mol·L-1 EDTA溶液滴定至终点,消耗EDTA溶液7.50mL。(已知Ca2+、Mg2+、Fe3+与EDTA反应的化学计量比均为1∶1)
(1)日常生活中可用____检验某水样是硬水还是软水。
(2)加入数滴稀盐酸并煮沸的目的是______。
(3)加入三乙醇胺溶液的目的是_____。
(4)试计算水样钙硬度和水样总硬度(写出计算过程)。_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com