
我国古代科技高度发达,下列有关古代文献的说法,错误的是
A. 晋代葛洪的《抱朴子》记载“丹砂烧之成水银,积变又成丹砂”,是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体
B. 汉朝的《淮南万毕术》、《神农本草经》记载“白青(碱式碳酸铜)得铁化为铜”,“石胆…能化铁为铜”都是铜可以用铁来冶炼
C. 清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素
D. 明朝的《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露。”该段文字记载了白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
下列各离子组在指定的溶液中一定能大量共存的是 ( )
①常温在C(H+)/C(OH-)= 10-10溶液中:K+、Na+、CH3COO-、SO42﹣
②常温pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水电离出的H+浓度c(H+)=10﹣12mol•L?1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙变红色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:填空题
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程示意如下:
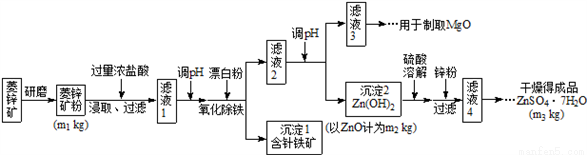
请回答下列问题:
(1)将菱锌矿研磨成粉的目的是:______________________________。
(2)漂白粉的有效成分是NaClO,请完成“氧化除铁”步骤中反应的离子方程式:_______________________
□Fe(OH)2+ □ClO- + □_____= □Fe(OH)3 + □ Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是____________(不用考虑化学式中各元素的排列顺序)。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________。
Mg(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 10.4 | 6.4 |
沉淀完全的pH | 12.4 | 8.0 |
开始溶解的pH | — | 10.5 |
(5)假设各步转化均完全,分析图中数据可知:菱锌矿粉中ZnCO3的质量是_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省广州市高一上学期期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. Na与氧气反应因氧气用量不同,产物不同
B. Na2O和Na2O2中阳阴离子物质的量之比均为2:1
C. Na2CO3和NaHCO3的水溶液都呈碱性,它们都属于碱
D. Na2O和Na2O2都能与水反应生成对应的碱,它们都属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:选择题
在Na+浓度为0.9mol﹒L-1的某澄清溶液中,还可能含有下表中中的若干种离子:取该溶液100mL进行如下实验(气体体积在标准状况下测定):
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
Ⅰ.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体
Ⅱ.将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量固体质量为3.6g
Ⅲ.在Ⅱ的滤液中滴加BaC12溶液,无明显现象。下列说法不正确的是
A. K+一定存在,且c(K+ )≤1.3mol • L-1
B. 实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+
C. 实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓
D. 实验Ⅲ能确定一定不存在SO42-
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三2月月考理科综合化学试卷(解析版) 题型:简答题
铈元素(Ce)是镧系金属中自然丰度最高的一种,常见价态有+3、+4,铈的合金耐高温,可以用来制造喷气推进器零件。
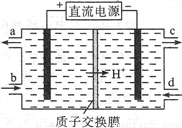
(1)雾霾中含有大量的污染物NO,可以被Ce4+溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1),该反应氧化剂与还原剂的物质的量之比为___________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如右图所示。
①Ce4+从电解槽的__________(填字母序号)口流出。
②写出阴极的电极反应式____________________________。每消耗1mol NO2-,阴极区H+物质的量减少______mol。
(3)铈元素在自然中主要以氟碳矿形式存在,主要化学成分为CeFCO3,工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:
①焙烧过程中发生的主要反应方程式为______________________________________。
②酸浸过程中有同学认为用稀硫酸和H2O2替换盐酸更好,他的理由是_________________________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s) + 3KCl(aq) 3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是______________________。
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三2月月考理科综合化学试卷(解析版) 题型:选择题
苯乙烯的结构为 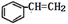 ,该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有( )
,该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有( )
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,需经过制取NH3、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
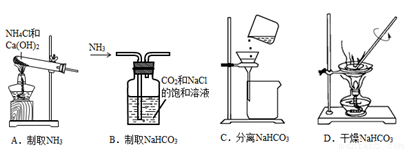
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一下学期分班考试化学试卷(解析版) 题型:选择题
工业上冶炼锡的第一步反应原理为2SnO2+3C===2Sn+aM↑+CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原
B. a的值为3
C. 反应后元素化合价升高生成的物质有两种
D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com