
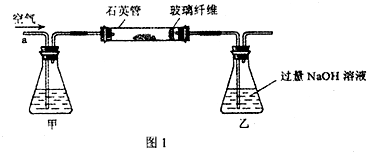
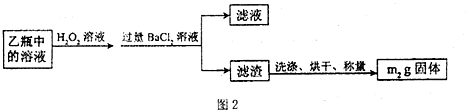
| 11 |
| 4 |
| 1 |
| 2 |
| 11 |
| 4 |
| 1 |
| 2 |
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |
| 2.8CV |
| m1 |
| 11 |
| 4 |
| 1 |
| 2 |
| m2 |
| 233 |
| m2 |
| 233 |
| m2 |
| 233 |
| 32m2 |
| 233m1 |
| 5CV× 10-3×10mol× 56g/mol |
| m1 |
| 2.8CV |
| m1 |
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |


科目:高中化学 来源:2007年普通高等学校招生全国统一考试、化学(广东卷) 题型:038
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol·L-1。计算该条件下SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol·L-1。计算该条件下SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有___________(填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更重要的化工原料,反应的化学方程式为___________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版) 题型:填空题
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称 |
溶度积(Ksp) |
pH值 |
|
|
开始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
化学工业在国民经济中占有极其重要的地位,江苏省是国内最早的硫酸生产基地之一。主要方程式和主要设备: (黄铁矿的主要成分为FeS2) 4FeS2+11O2 = 2Fe2O3+8SO2 (沸腾炉) 2SO2+O2![]() 2SO3 (接触室) SO3+H2O=H2SO4(吸收塔)
2SO3 (接触室) SO3+H2O=H2SO4(吸收塔)
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.接触室的反应使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触室中的氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(2)0.1mol/L的NaHSO3溶液中,有关粒子浓度由大到小的顺序为:
c (Na+)>c (HSO3-)>c (SO32-)>c (H2SO3)
①该溶液中c (H+) c (OH-)(填“>”、“=” 或“<” ),其理由是(用离子方程式表示): 。
②现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是 ,反应的离子方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com