
室温时,向20 mL 0.1 mol/L醋酸溶液中不断滴入0.1 mol/L NaOH溶液,溶液pH变化曲线如图所示。下列关于溶液中离子浓度大小关系的描述正确的是
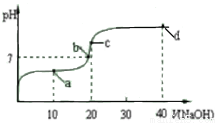
A.a点时:c(CH3COOH) c(CH3COO-) c(H+) c(Na+) c(OH-)
B.b点时:c(Na+) c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+) c(OH-) c(CH3COO-) c(H+)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年河北省高二上二调考试化学试卷(解析版) 题型:选择题
一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g) Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(Ls)
B.将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D若升高温度,X的体积分数增大,则正反应的△H>0
查看答案和解析>>
科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列现象或事实可用同一原理加以解释和说明的是
A.氯化铵和碘都可以用加热法进行提纯
B.浓硫酸和浓盐酸长期暴露在空气中浓度降低
C.硫酸亚铁溶液和氢氧化钠溶液在空气中久置后均会变质
D.二氧化硫气体均能使高锰酸钾溶液和溴水褪色
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:填空题
请根据化学学科中的基本理论,回答下列问题
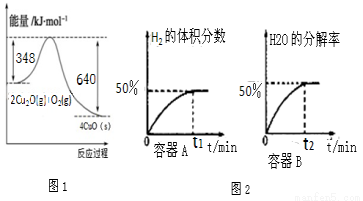
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。火法还原CuO可制得Cu2O.已知:1克C(s)燃烧全部生成CO时放出热量9.2kJ;Cu2O(s)与O2(g)反应的能量变化如图1所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O.该反应的化学方程式为______
(3)某兴趣小组同学以纳米级Cu2O催化光解水蒸气并探究外界条件对化学平衡的影响.
①在体积均为1L,温度分别为T1、T2的A、B两密闭容器中都加入纳米级Cu2O并通人0.1mol水蒸气,反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ•mol-1经测定A、B两容器在反应过程中发生如图2所示变化,则A、B两容器反应的温度T1________T2(填“<”、“=”或“>”),该过程中A容器至少需要吸收能量________kJ
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H2O(g)分解率的措施是(填序号)_________.
A.向平衡混合物中充入Ar B.升高反应的温度
C.增大反应体系的压强 D.向平衡混合物中充人O2
(4)25℃时,H2SO3═HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=_________mol/L.
查看答案和解析>>
科目:高中化学 来源:2016届江西师大附中,九江一中高三上期中化学试卷(解析版) 题型:选择题
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )

A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②不一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2016届甘肃会宁第一中学高三上第三次月考理化学试卷(解析版) 题型:选择题
将甲气体通入BaCl2溶液,未见沉淀生成,然后通入乙气体,有沉淀生成,则甲、乙气体不可能是 ( )
A.SO2、H2S B.SO2、NO2 C. NH3、CO2 D.CO2、SO2
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
化学无处不在,下列与化学有关的说法不正确的是
A.黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成
B.可用蘸浓硫酸的棉棒检验输送氨气的管道是否漏气
C.碘是人体必需微量元素,所以要适量吃富含碘酸根原子团的食物
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期12月第四次月考化学试卷(解析版) 题型:选择题
在铁的氧化物和氧化铝组成的混合物中,加入2mol/L硫酸溶液65mL,恰好完全反应。所得溶液中Fe2+能被标准状况下112mL氯气氧化。则原混合物中金属元素和氧元素的原子个数之比为( )
A.5 : 7 B.4 : 3 C.3 : 4 D.9 : 13
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期12月月考理综化学试卷(解析版) 题型:推断题
[化学—选修3:物质结构与性质]
X、Y、Z、M、W均为周期表中前四周期的元素.X元素的基态原子外围电子排布式为3s2;Y原子的L能层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;W为过渡元素,它的基态原子外围电子排布成对的电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
(1)W的基态原子的外围电子排布图为 其基态原子核外有 种不同电子运动状态;
(2)Z的氢化物的沸点比其下一周期同族元素氢化物的沸点高的原因是
。
(3)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为 ;与YM分子互为等电子体的离子的化学式为 。(写一种即可)
(4)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图A、B所示:
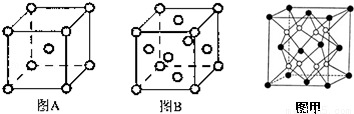
图B中原子堆积方式为 ,A、B中W原子的配位数之比为 。A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为 。
(5)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com