
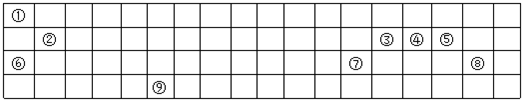
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑥ | ⑧ |
 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.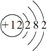 .
.分析 由表可知①~⑧号元素的种类分别是:①是N;②是Na;③是Mg;④是Al;⑤是Si;⑥是K;⑦是Cl;⑧是Br;由此分析解答.
解答 解:(1)②是Na;③是Mg;④是Al,金属性最强的是钠,最高价氧化物对应水化物的碱性最强,故答案为:NaOH;
(2)电子层数越多半径越大,电子层数相同时,核电荷数越多半径越小,所以半径由大到小的顺序排列为K>Na>Mg,故答案为:K>Na>Mg;
(3)N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ;实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O,故答案为:
;实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O,故答案为: ;Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
;Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
(4)镁原子的结构示意图为: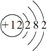 ;硅是半导体材料,故答案为:
;硅是半导体材料,故答案为: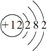 ;半导体;
;半导体;
(5)向元素钠的单质与水反应后的溶液是氢氧化钠,其中加入元素铝的单质,发生反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(6)通过单质之间的置换反应来证明非金属性的强弱,反应的化学方程式为:Cl2+2Brˉ═Br2+2Clˉ,故答案为:Cl2+2Brˉ═Br2+2Clˉ.
点评 本题是一道元素周期表的推断题,要求学生熟悉周期表的结构、元素的递变规律以及元素在周期表的位置,掌握元素和化合物的知识.


科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”释放的甲烷属于烃 | |
| B. | “可燃冰”的分解与释放,可能会诱发海底地质灾害,加重温室效应 | |
| C. | “可燃冰”将成为人类的后续能源 | |
| D. | “可燃冰”是水变的油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关于PHB的叙述中不正确的是( )
,下列关于PHB的叙述中不正确的是( )| A. | 它能发生水解反应 | |
| B. | 它在微生物作用下可降解成CO2和水 | |
| C. | 它可能是由一种含羟基的羧酸经缩聚反应而得 | |
| D. | 制备它的单体为HCOOH和CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ①~⑧是元素周期表中前四周期的8种元素,其相对位置如图所示.
①~⑧是元素周期表中前四周期的8种元素,其相对位置如图所示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将 SO2通入水中 | B. | 烧碱溶于水 | C. | 将 HCl 通入水中 | D. | NaHSO4溶于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
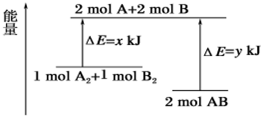
| A. | 该反应是吸热反应 | |
| B. | 断裂 1mol A-A 键和 1mol B-B 键能放出xkJ 的能量 | |
| C. | 断裂 2mol A-B 键需要吸收ykJ 的能量 | |
| D. | 2mol AB 的总能量高于 1 mol A2和 1mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
反应其△H= -122 kJ·mol-1,∆S=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com