
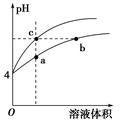
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
| D.a、b、c三点溶液水的电离程度a>b>c |
 NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。

科目:高中化学 来源:不详 题型:单选题
| A.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
| B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| C.常温下,向NH4Cl溶液中加入氨水至溶液的pH=7,此时溶液中c(NH4+)>c(C1-) |
| D.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.存在电离平衡HC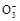  H++C H++C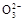 |
B.存在水解平衡HC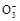 +H2O +H2O H2CO3+OH- H2CO3+OH- |
| C.将溶液加热蒸干、灼烧得Na2O2固体 |
D.加入NaOH固体,恢复到原温度,c(OH-)、c(C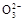 )均增大 )均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在稀盐酸中c(H+)=c(Cl-)+c(OH-) |
| B.常温下,在0.1mol/L的硫酸铵溶液中由水电离出的c(OH-)>10-7mol/L |
| C.如果Na2A的水溶液显中性,该溶液中一定没有电离平衡 |
| D.热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HR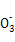 )+2c(R )+2c(R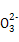 ) ) |
| B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(N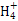 ):①<③<② ):①<③<② |
| D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数:N前>N后 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质 |
| B.在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
| C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大 |
| D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入少量盐酸 | B.加KOH固体 | C.加水 | D.加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是| A.加入NaOH固体 | B.加入冰醋酸 | C.增大压强 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3溶液 | B.NH4HCO3溶液 | C.NaHCO3溶液 | D.NaHSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com