
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性, |
| Z | 元素最高正价是+7价 |
分析 短周期元素,T元素原子M层上的电子数是原子核外电子层数的2倍,原子有3个电子层,M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素,据此解答.
解答 解:短周期元素,T元素原子M层上的电子数是原子核外电子层数的2倍,原子有3个电子层,M层上有6个电子,则T为S元素;X元素原子最外层电子数是次外层电子数的2倍,则X原子只能有2个电子层,最外层电子数为4,则X为C元素;常温下Y元素单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则Z为Cl元素.
(1)由上述分析可知,元素X的一种核素可测定文物年代,这种核素的符号是146C,
故答案为:146C;
(2)元素Y为氮,氢化物的化学式是:NH3,该氢化物可与该元素的最高价氧化物的水化物生成盐为硝酸铵,该盐中的化学键类型是:离子键、共价键,
故答案为:NH3;离子键、共价键;
(3)Z为Cl元素,T为S元素,同周期自左而右非金属性增强,故Cl元素非金属性强于S,
a.物理性质不能说明非金属性强弱,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,故b正确;
c.与氢氧化钠溶液反应不能说明非金属性强弱,如氧气不能与氢氧化钠溶液反应,非金属性O>S,故c错误;
故答案为:Cl;b;
(4)T、X、Y、Z四种元素的最高价氧化物的水化物分别为:H2SO4、H2CO3、HNO3、HClO4,碳酸是弱酸,其它酸为强酸,碳酸明显不同于其他三种,
故答案为:H2CO3;碳酸是弱酸,其它酸为强酸.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题的关键,注意金属性、非金属性强弱不变.


科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法: 的名称为3,3,6三甲基4乙基庚烷 的名称为3,3,6三甲基4乙基庚烷 | |
| B. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸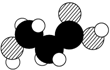 | |
| C. | 能用新制氢氧化铜和NaOH溶液鉴别甘油、葡萄糖溶液、乙酸钠溶液 | |
| D. | 木糖醇( 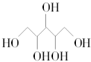 )和葡萄糖( )和葡萄糖(  )互为同系物,均属于糖类 )互为同系物,均属于糖类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2→CH3Cl+HCl | B. | CH2=CH2+H2O→CH3CH2OH | ||
| C. |  +HO-NO2→ +HO-NO2→ +H2O +H2O | D. | CH3CH2OH→CH2=CH2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将等物质的量的CH4和Cl2在光照下反应生成纯净的CH3Cl | |
| B. | 将苯与浓硝酸和浓硫酸混合水浴加热制取硝基苯 | |
| C. | 用新制Cu(OH)2悬浊液鉴别葡萄糖和蔗糖 | |
| D. | 用浓硝酸鉴别淀粉溶液和鸡蛋白溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
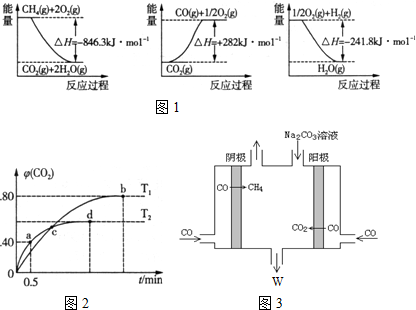
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的最高价氧化物为RO3 | B. | R一定是第ⅦA族元素 | ||
| C. | R的气态氢化物能燃烧 | D. | R的气态氢化物易溶于水显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
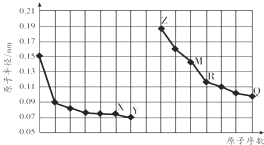
| A. | R在周期表的第15列 | |
| B. | 元素Y气态氢化物的沸点小于元素Q气态氢化物的沸点 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③④ | C. | ①②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | RO4- | B. | RO3- | C. | RO42- | D. | RO5- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com