
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 12 种 | B. | 24 种 | C. | 36 种 | D. | 40 种 |
分析 先找出丁基的同分异构体,再找出-C3H5Cl2的同分异构体,然后找出有机物的种类数.
解答 解:丁烷为CH3CH2CH2CH3时,分子中有2种不同的H原子,故有2种丁基;
丁烷为CH3CH(CH3)CH3时,分子中有2种不同的H原子,故有2种丁基,
故丁基(-C4H9)共有4种;
C3H5Cl2的碳链为 或
或 ,当为
,当为 ,2个氯在一号位或者二号位或者三号位有3种;1个氯在一号位,剩下的一个氯在二号或者三号,2种;1个氯在二号位剩下的一个氯在三号位,1种,总共6种,
,2个氯在一号位或者二号位或者三号位有3种;1个氯在一号位,剩下的一个氯在二号或者三号,2种;1个氯在二号位剩下的一个氯在三号位,1种,总共6种,
当为 ,2个氯在同一个碳上有1种;在两个左边的碳和中间的碳上,1种;左边的碳上和右边的碳上,1种,共3种,故-C3H5Cl2共有9种;
,2个氯在同一个碳上有1种;在两个左边的碳和中间的碳上,1种;左边的碳上和右边的碳上,1种,共3种,故-C3H5Cl2共有9种;
所以该有机物共有36种,
故选C.
点评 本题考查同分异构体的书写,难度不大,注意二氯代物的书写可以采用定一议二法解题以及组合法的使用.


科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是还原产物 | |
| C. | H2C2O4在反应中被还原 | |
| D. | 1mol H2C2O4参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与乙苯互为同系物 | B. | 分子中共直线的原子最多有4个 | ||
| C. | 分子中共平面的碳原子最多有13个 | D. | 与甲苯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
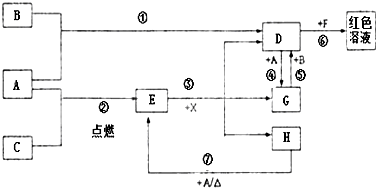 A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
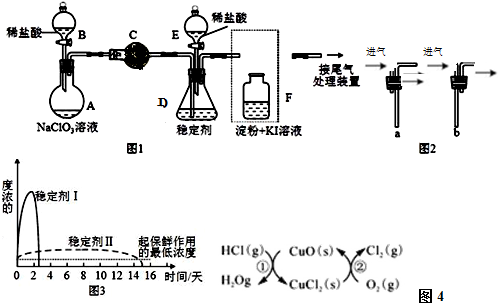
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com