
 ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )| A. | Ts是第七周期第ⅦA族元素 | |
| B. | Ts的同位素原子具有相同的电子数 | |
| C. | Ts在同族元素中非金属性最弱 | |
| D. | 中子数为176的Ts核素符号是${\;}_{117}^{176}$Ts |
分析 A.根据原子核外电子排布规则,该原子结构示意图为 ,据此判断该元素在周期表中的位置;
,据此判断该元素在周期表中的位置;
B.同种元素的不同核素互为同位素,同种元素原子一定具有相同电子数;
C.同一主族元素,原子序数越大非金属性越弱;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.该原子结构示意图为 ,该元素位于第七周期、第VIIA族,故A正确;
,该元素位于第七周期、第VIIA族,故A正确;
B.同位素具有相同质子数、不同中子数,而原子的质子数=核外电子总数,则TS的同位素原子具有相同的电子数,故B正确;
C.同一主族元素中,随着原子序数越大,元素的非金属性逐渐减弱,则TS在同族元素中非金属性最弱,故C正确;
D.该元素的质量数=质子数+中子数=176+117=293,该原子正确的表示方法为:117293Ts,故D错误;
故选D.
点评 本题考查原子结构与元素性质,题目难度不大,明确原子结构与元素周期律的关系为解答关键,注意掌握原子构成及表示方法,试题培养了学生的分析能力及灵活应用能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3molH2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A. | 2 c1>c3 | B. | a1+a3<1 | C. | 2 p2<p1 | D. | a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 结论 | |
| A. | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的1,2-二溴乙烷无色、可溶于四氯化碳 |
| B. | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
| C. | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸的酸性 |
| D. | 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的氯甲烷具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,足量Fe与22.4 L Cl2反应,转移的电子数为2NA | |
| B. | 0.1molO2完全反应时,转移的电子数一定为 0.4 NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为 0.2NA | |
| D. | 常温常压下,100 g 17% H2O2水溶液中含氧原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (b)、
(b)、 (d)、
(d)、 (p)的分子式均为C6H6,下列说法正确的是( )
(p)的分子式均为C6H6,下列说法正确的是( )| A. | b的同分异构体只有d和p两种 | |
| B. | b、d、p的二氯代物均只有三种 | |
| C. | b、d、p均可与酸性高锰酸钾溶液反应 | |
| D. | b、d、p中只有b的所有原子处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
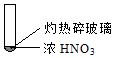 | 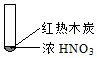 | 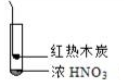 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
查看答案和解析>>
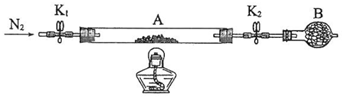
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
| B. | 向电石中加入饱和食盐水制乙炔,并将产生的气体直接填入酸性高锰酸钾溶液中,溶液紫红色褪去 | 记明乙炔能被酸性高锰酸钾氧化 |
| C. | 常温下,测得饱和Na2S溶液的PH大于饱和Na2CO3溶液 | 常温下水解程度:S2->CO32- |
| D. | 向分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,且上层溶液至紫色 | CC14可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com