
分析 (1)依据溶液中铵根离子水解,溶液呈酸性,水解程度微弱,分析比较;
(2)在NaHCO3溶液中存在碳酸氢根离子的水解平衡和电离平衡;水的电离平衡;溶液显碱性是因为溶液中碳酸氢根离子的水解程度大于电离程度;
(3)配制氯化铁溶液需要防止水解而变浑浊;NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;
(4)氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化;依据溶度积分别计算.
解答 解:(1)铵根离子水解,溶液呈酸性,c(H+)>c(OH-),.1mol•L-1的(NH4)2SO4溶液中,铵根离子水解微弱,所以得到溶液中的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(2)在NaHCO3溶液中存在碳酸氢根离子的水解平衡为:HCO3+H2O?H2CO3+OH-,电离平衡为:HCO3-?H++CO32-;而以水解为主,即碳酸氢根离子的水解程度大于电离程度溶液,故显碱性;
故答案为:HCO3-的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性;
(3)实验室中配制FeCl3溶液时通常需要向其中加盐酸抑制Fe3+水解,NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;反应的离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑,
故答案为:盐酸;Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;
(4)100mL 0.2mol•L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,③100mL 0.1mol•L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;④100mL 0.1mol•L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述银离子浓度大小顺序为:②①④③,
故答案为:②①④③.
点评 本题考查了离子浓度大小比较、盐类水解的应用,题目难度中等,涉及溶液中离子浓度大小的比较、溶液中平衡的分析、溶液配制、溶度积的计算应用等知识,试题考查较为综合,明确盐的水解原理及其影响为解答关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为1mol•l-1 | |
| C. | 容器②中反应达到平衡时放出的热量为Q | |
| D. | 若将容器①体积缩小为0.40 L,则达平衡时放出的热量大于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
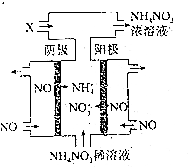
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | B的转化率降低 | D. | C的产率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉中混有铁粉:加入过量盐酸充分反应,过滤 | |
| B. | CO2中混有HCl:将其通入NaOH溶液,洗气 | |
| C. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| D. | FeCl2溶液中混有少量FeCl3:加入Fe粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水分子不可再分 | |
| B. | 水分子由氢和氧两种元素组成 | |
| C. | 水分子由氧原子和氢原子构成 | |
| D. | 二氧化碳分子是保持干冰化学性质的最小微粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com