
分析 根据该氧化物的化学式可知n(NOx)=n(N)=0.2mol,然后根据M=$\frac{m}{n}$计算出其摩尔质量;根据所得摩尔质量可知其相对分子质量,然后列式计算出x.
解答 解:9.2g氮的氧化物NOx中含氮原子0.2mol,则n(NOx)=n(N)=0.2mol,NOx的摩尔质量为:M(NOx)=$\frac{9.2g}{0.2mol}$=46g/mol,
即NOx的相对分子质量为46,则14+16x=46,解得:x=2,
故答案为:46g/mol;2.
点评 本题考查了物质的量的计算,题目难度不大,明确摩尔质量的概念及表达式即可解答,注意掌握物质的量与摩尔质量等物理量之间的关系,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
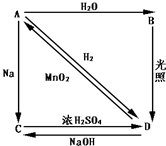 常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
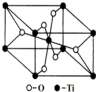 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )
在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )| A. | 曲线a代表的是Zn的反应,曲线b代表的是Mg的反应 | |
| B. | 两个反应分别在2min、3min时达到化学平衡 | |
| C. | Mg和Zn的反应速率之比为3:2 | |
| D. | 用Fe代替Zn,其他条件不变,绘出的图象完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的水溶液中,K+、Mg2+、I-、MnO4- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- | |
| C. | 在强碱溶液中:Na+、K+、CO32-、NO3- | |
| D. | pH=1的NaNO3的水溶液中,NH4+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是物质的量的单位,每摩尔物质含有6.02×1023个分子 | |
| B. | 1 mol氧的质量为16 g | |
| C. | 0.5 molHe约含有6.02×1023个电子 | |
| D. | 2H既可表示2个氢原子又可表示2 mol氢分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
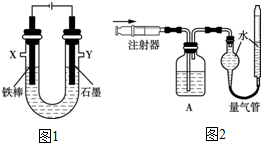
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com