
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:① 2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
CO的燃烧热为________。CO将NO2还原为单质的热化学方程式为______________。
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g) ![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:酸性HCO3-<HClO<H2CO3)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填填“小于”,“大于”)。
【答案】283kJ·mol1 2NO2(g)+4CO(g)=N2(g)+4CO2(g) H=-1196 kJ·mol1 高温 CO2+ ClO-=HClO+ HCO3- 2.67 a<b 小于
【解析】
(1)CO的燃烧热为1molCO完全燃烧生成1molCO2时释放的能量;CO将NO2还原为单质的化学方程式为2NO2+4CO=N2+4CO,结合反应:①2CO(g)+O2(g)2CO2(g)△H=-566.0KJmol-1、②N2(g)+O2(g)2NO(g)△H=+180.5KJmol-1、③2NO(g)+O2(g)2NO2(g)△H=-116.5KJmol-1,根据盖斯定律计算此反应的反应热,写出热化学方程式;
(2)①根据△G=△H-T△S判断,△G<0,反应自发进行;
②根据碳酸和次氯酸的电离平衡常数进行比较次氯酸与碳酸、碳酸氢根离子离子酸性大小,从而得出反应产物,写出反应的离子方程式;
(3(3)①依据图表数据列式计算平衡浓度,结合化学平衡常数表达式计算;
②由于CO与H2O的化学计量数相等都为1,所以平衡时两者消耗量相等。要使CO转化率大于H2O的转化率,则增加H2O的物质的量;
③第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应。
(1)已知2CO(g)+O2(g)2CO2(g)△H=-566.0kJmol-1,可知1molCO完全燃烧生成1molCO2时释放的能量为![]() =283kJ,则CO的燃烧热为283kJ/mol;已知:①2CO(g)+O2(g)2CO2(g)△H=-566.0kJmol-1、②N2(g)+O2(g)2NO(g)△H=+180.5kJmol-1、③2NO(g)+O2(g)2NO2(g)△H=-116.5kJmol-1,根据盖斯定律可知,①×2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO(g),则△H=(-566.0kJmol-1)×2-(+180.5kJmol-1)-(-116.5kJmol-1)=-1196kJ/mol,则CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g)△H=-1196kJ/mol,
=283kJ,则CO的燃烧热为283kJ/mol;已知:①2CO(g)+O2(g)2CO2(g)△H=-566.0kJmol-1、②N2(g)+O2(g)2NO(g)△H=+180.5kJmol-1、③2NO(g)+O2(g)2NO2(g)△H=-116.5kJmol-1,根据盖斯定律可知,①×2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO(g),则△H=(-566.0kJmol-1)×2-(+180.5kJmol-1)-(-116.5kJmol-1)=-1196kJ/mol,则CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g)△H=-1196kJ/mol,
(2)①由热化学反应方程式可知,该反应为焓增、熵增过程,即△H>0、△S>0,必须满足△G=△H-T△S<0反应才能自发进行,所以在高温下能够自发进行;
②由于酸性HCO3-<HClO<H2CO3,所以碳酸能够与次氯酸钠溶液反应生成碳酸氢钠和次氯酸,反应的离子方程式为:ClO-+H2O+CO2=HCO3-+HClO;
(3)①实验1条件下该反应的三段式为:
H2O(g)+CO(g)CO2(g)+H2(g)
初始浓度(mol/L) 1 2 0 0
转化浓度(mol/L)0.8 0.8 0.8 0.8
平衡浓度(mol/L)0.2 1.2 0.8 0.8
K=![]() =
=![]() =2.67;
=2.67;
②由于CO与H2O的化学计量数相等都为1,所以平衡时两者消耗量相等。要使CO转化率大于H2O的转化率。则增大H2O的物质的量,即a<b;
③实验1中CO的转化率为![]() ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为![]() ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,故△H小于0。
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,故△H小于0。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
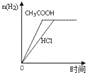

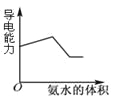
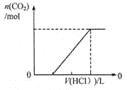
图1 图2 图3 图4
A.图1表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉
B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2
C.图3表示表示向盐酸和醋酸混合溶液中滴入氨水
D.图4表示在含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中通常用图象直观地描述化学反应进程或结果。下列图象及描述不正确的是
A.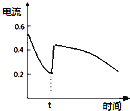 表示
表示![]() 原电池反应过程中的电流强度的变化,t时可能加入了双氧水
原电池反应过程中的电流强度的变化,t时可能加入了双氧水
B.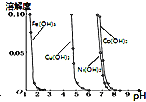 由图可知,可以通过调节溶液pH的方法除去
由图可知,可以通过调节溶液pH的方法除去![]() 溶液中的
溶液中的![]() 、
、![]() 、
、![]()
C.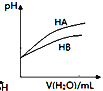 表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度下溶液的pH:
表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度下溶液的pH:![]()
D.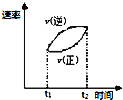 表示可逆反应
表示可逆反应![]() ,
,![]() ,在
,在![]() 时刻加热,
时刻加热,![]() 时刻达到新平衡,速率随时间变化的曲线图
时刻达到新平衡,速率随时间变化的曲线图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1所示),用环己醇制备环己烯。

已知:![]()
![]()
![]() +H2O
+H2O

(1)制备粗品:
将12.5mL环己醇与1mL浓硫酸加入试管A中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①在试管中混合环已醇和浓硫酸操作时,加入药品的先后顺序为___。
②如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是(_____)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③将试管C置于冰水中的目的是___。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。向粗品中加入饱和食盐水,振荡、静置、分层,环己烯在___层(填“上”或“下”),分液后用___(填字母)洗涤。
A.酸性KMnO4溶液 B.稀硫酸 C.Na2CO3溶液
②再将提纯后的环己烯按如图2所示装置进行蒸馏。图中仪器a的名称是___。实验中冷却水从___(填字母)口进入。蒸馏时要加入生石灰,目的是___。若在制备粗品时环已醇随产品一起蒸出,则实验制得的环己烯精品质量___(填“高于”、“低于”)理论产量。本实验所得到的环已烯质量为6.25g,则产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如图,说法错误的是

A.流程②的反应说明Ⅰ的非金属性弱于Cl
B.经①和④所得溶液中,I-的浓度后者大于前者
C.氯元素的相对原子质量是35.5,则存在的35Cl、37Cl所占的百分比约为3:1
D.若在流程②和⑤中要得到等量的I2,则需消耗的n(Cl2):n(KClO3)=5:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol CH4含有的电子数为NA
B.标准状况下,2.24 L CCl4中含有的氯原子数为0.4 NA
C.1 mol丙烯醛分子中含有的双键数为NA
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
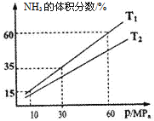
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;列出计算式即可,无需化简)。
②T1_____________T2(填“>”、“<”或“=”)。
③达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将______(填“增大”“减小”或“不变”)
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g)→2N*;H2(g)→2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H
NH*;NH*+H![]() NH2*;NH2* +H*
NH2*;NH2* +H*![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
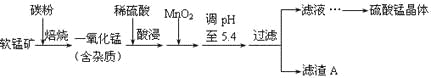
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)![]() pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
A.只有③④B.②③④C.①②③④D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com