
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
科目:高中化学 来源: 题型:
已知:R—CH===CH2+HX—→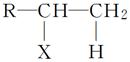 。
。
A、B、C、D、E有如下转化关系:
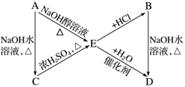
其中A、B是化学式均为C3H7Cl的两种同分异构体。根据图中各物质的转化关系,填写下列空白:
(1)A、B、C、D、E的结构简式:A________、B________、C________、D________、E________。
(2)完成下列反应的化学方程式:
①A—→E____________________________________________________________________;
②B—→D____________________________________________________________________;
③C—→E_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2、CH4、BF3都是非极性分子,HF、H2O、NH3都是极性分子,由此推测ABn型分子是非极性分子的经验规律正确的是( )
A.所有原子在同一平面
B.分子中每个键的键长应相等
C.在ABn中A原子没有孤对电子
D.A的相对原子质量小于B
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )

A.W、R元素单质分子内的化学键都是非极性键
B.X、Z元素都能够形成双原子分子
C.键能W-H>Y-H,键的极性Y-H>W-H
D.键长X-H<W-H,键能X-H<W-H
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量的SO2通入下列各溶液中,所含离子还能大量共存的是( )
A.K+、SiO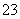 、Cl-、NO
、Cl-、NO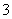
B.H+、NH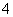 、Al3+、SO
、Al3+、SO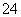
C.Na+、Cl-、MnO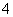 、SO
、SO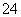
D.Na+、CO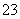 、CH3COO-、HCO
、CH3COO-、HCO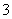
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Mg2+、K+、SO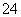 、NO
、NO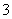
B.使酚酞变红色的溶液:Na+、Cu2+、HCO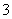 、NO
、NO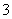
C.0.1 mol·L-1 AgNO3溶液:H+、K+、SO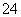 、I-
、I-
D.0.1 mol·L-1 NaAlO2溶液:H+、Na+、Cl-、SO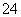
查看答案和解析>>
科目:高中化学 来源: 题型:
某未知溶液可能含Cl-、CO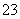 、Na+、SO
、Na+、SO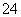 、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )
、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )
A.一定有Cl- B.一定有SO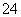
C.一定没有Al3+ D.可能有CO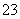
查看答案和解析>>
科目:高中化学 来源: 题型:
依据Mg、Al单质的性质,思考回答下列问题。
(1)铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能?
(2)Al既能溶于强酸,又能溶于强碱,所以说“Al既有金属性,又有非金属性”你认为这种说法是否恰当?为什么?
(3)铝与酸、碱反应的实质是什么?氧化剂是什么?
(4)镁在空气中充分燃烧,所得固体产物可能有哪些:________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将镁、铝的混合物共0.2 mol, 溶于200 mL 4 mol·L-1的盐酸溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
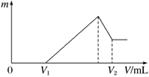
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160 mL时,则金属粉末中n(Al)=________ mol。
(2)0~V1段发生的反应的离子方程式为__________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4 mol·L-1的硫酸溶解此混合物后,再加入840 mL 2 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com