
| A. | 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 | |
| B. | 浓度均为0.1 mol•L-1的 HCOONa和NaCl溶液中阴离子的物质的量浓度之和:前者大于后者 | |
| C. | 0.2 mol•L-1 CH3COONa 与 0.1 mol•L-1盐酸等体积混合后的溶液 (pH<7)中,某些粒子浓度大小关系:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| D. | 0.4 mol•L-1 HCOOH 与 0.2 mol•L-1 NaOH 等体积混合后的溶液中,某些粒子浓度大小关系:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+) |
分析 A.pH相同的HCOOH和CH3COOH,浓度:c(HCOOH)<c(CH3COOH),用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点时,酸的浓度越大,消耗的碱体积越大;
B.电离平衡常数越大,其离子水解程度越小,根据电离平衡常数知,其离子水解程度:CH3COO->NH4+>HCOO-,任何电解质溶液中都存在电荷守恒,所以得出c(HCOO-)+c(OH-)=c(Na+)+c(H+)=0.1mol/L+c(H+)、c(NH4+)+c(H+)=c(Cl-)+c(OH-)=0.1mol/L+c(OH-),水解程度NH4+>HCOO-,所以前者c(H+)大于后者c(OH-);
C.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(HCOO-)+c(OH-)=c(Na+)+c(H+),混合溶液中溶质为等物质的量浓度的HCOOH和HCOONa;
D.二者混合后溶液中的溶质为等物质的量浓度的CH3COONa、CH3COOH和NaCl,混合溶液的pH<7,说明醋酸电离程度大于醋酸钠水解程度.
解答 解:A.pH相同的HCOOH和CH3COOH,浓度:c(HCOOH)<c(CH3COOH),用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点时,酸的浓度越大,消耗的碱体积越大,pH、体积相同的HCOOH和CH3COOH,物质的量前者小于后者,所以后者消耗的NaOH体积多,故A错误;
B.电离平衡常数越大,其离子水解程度越小,根据电离平衡常数知,其离子水解程度:CH3COO->NH4+>HCOO-,任何电解质溶液中都存在电荷守恒,所以得出c(HCOO-)+c(OH-)=c(Na+)+c(H+)=0.1mol/L+c(H+)、c(NH4+)+c(H+)=c(Cl-)+c(OH-)=0.1mol/L+c(OH-),水解程度NH4+>HCOO-,所以前者c(H+)大于后者c(OH-),所以浓度均为0.1 mol•L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者,阴离子的物质的量浓度之和:前者小于后者,故B错误;
C.二者混合后溶液中的溶质为等物质的量浓度的CH3COONa、CH3COOH和NaCl,混合溶液的pH<7,说明醋酸电离程度大于醋酸钠水解程度,甲酸是弱酸,其电离程度较小,所以粒子浓度大小顺序是c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故C正确;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(HCOO-)+c(OH-)=c(Na+)+c(H+),混合溶液中溶质为等物质的量浓度的HCOOH和HCOONa,甲酸电离程度大于水解程度,溶液显酸性,所以c(HCOOH)<c(Na+),所以得c(HCOO-)+c(OH-)>c(HCOOH)+c(H+),故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断能力,明确电离平衡常数与水解程度关系、溶液中存在的守恒是解本题关键,注意D中等量代换,题目难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
 央视3.15晚会曝光在液化石油气中掺混二甲醚的事件.二甲醚(常压下沸点-24.9℃)是一种可溶于水的化工原料,常被用作一些燃料的替代品,其结构式如图.下列有关二甲醚的叙述中正确的是( )
央视3.15晚会曝光在液化石油气中掺混二甲醚的事件.二甲醚(常压下沸点-24.9℃)是一种可溶于水的化工原料,常被用作一些燃料的替代品,其结构式如图.下列有关二甲醚的叙述中正确的是( )| A. | 二甲醚是一种有机物,属于非电解质 | |
| B. | 4.6g该物质中含有共价键的数目为7×6.02×1022 | |
| C. | 二甲醚与甲醇(CH3OH)互为同系物 | |
| D. | 0.5mol二甲醚完全燃烧生成22.4LCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
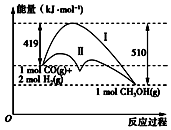 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)=CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)=CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应物△H=+91 kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 曲线Ⅱ使用催化剂,降低了反应的活化能 | |
| D. | 如果该反应生成液态CH3OH,则△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置能将电能转化为化学能 | B. | Zn为负极,Cu为正极 | ||
| C. | 电子由Cu电极经 流向Zn电极 流向Zn电极 | D. | 正极反应为 Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气主要含乙烯、丙烯和甲烷 | |
| B. | 限制氟利昂的使用是为了保护大气臭氧层 | |
| C. | 在船身适当位置装锌块可以避免船体遭受腐蚀 | |
| D. | 工业上冶炼像钠、钙、镁、铝这样的活泼金属,需采用电解法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C、136C、146C三种核素互为同素异形体 | |
| B. | 溶液、胶体和悬浊液这三种分散系的本质区别是能否透过滤纸或半透膜 | |
| C. | 等质量的甲烷按a,b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH4$→_{催化重整}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铝热反应实验说明:在一定条件下铝的还原性强于很多难熔金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Mg>Al>O>F | B. | 离子半径:O>F>Na>Mg>Al | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:RbOH<KOH<NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法 | |
| B. | 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品 | |
| C. | 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小 | |
| D. | 用SO2水溶液吸收Br2的离子反应方程式为Br2+SO2+2H2O═4H++SO42-+2Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com