
【题目】现有七种物质![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 组成一个化学方程式,已知
组成一个化学方程式,已知![]() 等三种物质为反应物,
等三种物质为反应物,![]() 难溶于水.下列判断正确的是
难溶于水.下列判断正确的是![]()
A.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
B.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
C.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
D.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的;D的单质晶体是分子晶体,原子最外层有两个未成对电子;E位于周期表的ds区,E元素原子最外层有一个未成对电子。回答下列问题:
(1)E2+的简化电子排布式是__________;甲和乙沸点较高的是___________(填化学式);
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形;则D显最高正价时与B形成的常见化合物的中心原子的杂化类型是_________
(3)同时由A、B、C、D四种元素组成的两种盐M和W,写出这两种盐溶液反应的离子方程式___________
(4)由B、D、E三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,[E(OH)4]2-的结构可用示意图表示为__________
(5)根据周期表对角线规则,铍和铝的性质有相似性,则书写铍单质和C的最高正价氧化物对应水化物溶液发生反应的离子方程式是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.45mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿![]() 主要成分是
主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质
、MgO等杂质![]() 中提取氧化铝的两种工艺流程如下:
中提取氧化铝的两种工艺流程如下:
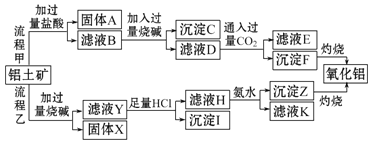
请回答下列问题:
![]() 固体A是______,沉淀F是______,沉淀I是______
固体A是______,沉淀F是______,沉淀I是______![]() 写出有关的化学式
写出有关的化学式![]()
![]() 流程甲中加入过量烧碱得到滤液D的离子方程式为______
流程甲中加入过量烧碱得到滤液D的离子方程式为______
![]() 流程乙加入烧碱有关的化学方程式为______、______
流程乙加入烧碱有关的化学方程式为______、______
![]() 流程乙中滤液H中加入氨水的有关离子方程式______
流程乙中滤液H中加入氨水的有关离子方程式______
![]() 滤液E中溶质的主要成分是___
滤液E中溶质的主要成分是___![]() 填化学式
填化学式![]() ,写出该溶质的一种用途______。
,写出该溶质的一种用途______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是( )

A. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C. 装置①可用于分离C2H5OH和H2O的混合物
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A为淡黄色固体,B的阳离子与A相同(其他物质均略去).
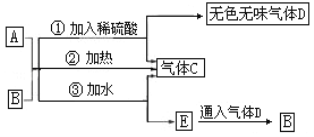
根据以上关系,回答下列问题:
(1)A的电子式为__________.
(2)A投入FeCl2溶液中的反应为_______________(请用一个化学方程式表示)
(3)若A、B按物质的量之比1:1.5混合在密闭容器中加热充分反应后,排出气体,则剩余的固体为_____________________________(写化学式)
(4)氢能被视为21世纪最具发展潜力的清洁能源,试回答下列问题:
①与化石燃料相比,氢气作为燃料的优点是__________________(答两点)。
②施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气,写出NaBH4与水反应的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列六种物质:![]() 、
、![]() 、CaO、MgO、
、CaO、MgO、![]() 、
、![]() .
.
(1)按照不同的分类标准,它们中有一种物质与其他物质有明显的不同,请找出这种物质,并写出分类的依据.① ______②______.
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应,![]() 与水反应的离子方程式是______.
与水反应的离子方程式是______.
(3)从上述氧化物中分别找出两种能相互反应的物质,写出一个非氧化还原反应的方程式和一个氧化还原反应的方程式,______.
(4)虽然分类的方法不同,但离子反应和氧化还原反应之间存在着一定的关系,请用简单的图示方法表示二者之间的关系:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H—H | N≡N | N—H |
键能/kJ·molˉ1 | a | b | c |
①工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=____ kJ·mol-1
2NH3(g) ΔH=____ kJ·mol-1
②合成氨反应的活化能很大,能加快反应速率但不改变反应活化能的方法是____。
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出肼作火箭燃料时反应的热化学方程式____。
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;

①肼-空气燃料电池的负极反应式为____。
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式____。
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在调节好pH和![]() 浓度的废水中加
浓度的废水中加![]() ,能氧化降解污染物。现用该方法降解污染物
,能氧化降解污染物。现用该方法降解污染物![]() ,控制
,控制![]() 、
、![]() 和
和![]() 的初始浓度相同,设计如下对比实验探究温度、pH对该降解反应速率的影响,测得
的初始浓度相同,设计如下对比实验探究温度、pH对该降解反应速率的影响,测得![]() 的浓度随时间变化的关系如下图。
的浓度随时间变化的关系如下图。

下列结论或推断不正确的是
A.实验①、②表明适当升高温度,降解反应速率增大
B.根据反应原理推断,温度过高,反而会使降解速率变慢
C.313K、![]() 时,在
时,在![]() 内,
内,![]() 的分解平均速率约为
的分解平均速率约为![]() mol/(L·s)
mol/(L·s)
D.室温下,实验过程中取样分析浓度可以采用迅速加碱调节溶液pH的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com