
 氨是一种重要的化工产品.
氨是一种重要的化工产品.| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
分析 (1)根据盖斯定律求解;
(2)根据可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不变进行判断;
(3)①温度越高达平衡所需的时间越短,然后结合图象分析反应的热效应,从而得出K的变化情况;
②根据三行式,结合平衡常数和反应速率的公式来求解;
(4)根据平衡时各物质的浓度计算其平衡常数,用浓度积与K比较大小判断反应的方向;
(5)碱性燃料电池中,负极上燃烧失电子发生氧化反应.
解答 解:(1)因为①Br2(g)+CaO(s)=CaBr2(s)+12O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则由盖斯定律①+②+③+④得到:H2O(g)?H2(g)+$\frac{1}{2}$O2(g)△H=+249KJ/mol,
故答案为:+249;
(2)根据反应N2(g)+3H2(g)=?2NH3(g)△H=-92.4kJ•mol-1,
A.速率之比与化学计量数成正比,2v(N2)正=v(NH3)逆,故A错误;
B.单位时间生成amolN2的同时消耗3amolH2,方向相反成正比例,故B正确;
C.混合气体的密度=$\frac{m}{V}$,混合气体的质量不变更,V反应前后不变,故密度不是变量,不能判断平衡,故C错误;
D.容器内的总压强为变量,故压强不再随时间而变化则平衡,故D正确;
E.amolN≡N键断裂的同时,有6amolN-H键断裂,方向相反成正比例,能作为平衡的标志,故E正确;
F.N2、H2、NH3的分子数之比为1:3:2任何时候均成立,故F错误,
故选:BDE;
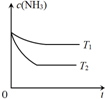
(3)①由图可知T2先达平衡状态,所以T1小于T2,而温度越高K越小,所以正反应为吸热反应,所以温度越高K值越大,故答案为:小于;小于;
②2NH3(g)?N2(g)+3H2(g)
起始浓度:0.050 0 0
变化浓度:0.04 0.02 0.06
平衡浓度:0.01 0.02 0.06
平衡时体系总的物质的量为=(0.01+0.02+0.06)×1=0.09mol;
反应在0~5min区间的平均反应速率v(N2)=0.025=0.004mol/(L•min);
故答案为:0.09mol;0.004mol/(L•min);
(4)一温度下,容器中气体压强与总的物质的量成正比,设平衡状态时混合气体的物质的量为x,
16.80:12.60=(1+3)mol:x,x=4mol×$\frac{12.60}{16.80}$=3mol,所以平衡时混合气体的物质的量为3mol,
设参加反应的氮气的物质的量为y,
N2(g)+3H2(g)?2NH3(g)物质的量减少
1mol 2mol
y (4-3)mol
1mol:2mol=y:(4-3)mol,
y=1mol×(4-3)mol÷2mol=0.5mol,
平衡时,c(N2)═0.25mol/L、
c(H2)=$\frac{3mol-0.5mol×3}{2L}$=0.75mol/L、
c(NH3)=0.5mol/L,化学平衡常数K=$\frac{0.{5}^{2}}{0.25×0.7{5}^{3}}$=2.37( mol/L)-2,
30min时再向该密闭容器中投入0.5molN2、0.5molH2和1molNH3,Qc=$\frac{{1}^{2}}{0.5×{1}^{3}}$<K,故此时反应正向进行;
故答案为:2.37( mol/L)-2;正向进行;
(5)碱性燃料电池中,负极上燃烧失电子发生氧化反应,所以该原电池中负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了化学反应能量变化、化学平衡状态判断、可逆反应特点、化学平衡常数的计算等知识,图象分析与化学平衡的计算应用本题难度中等,试题涉及的知识点较多,注意掌握化学平衡状态的判断方法、化学反应的可能性,电离平衡常数的计算方法.


科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油和自来水(蒸馏) | B. | 水溶液中的食盐和碘(分液) | ||
| C. | CaCO3和CaCl2(溶解、过滤、蒸发) | D. | 泥水中的不溶性泥沙(萃取) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中存在的共价键总数为0.1NA | |
| B. | 2.4g石墨中含有C-C键个数为0.4NA | |
| C. | 标准状况下,22.4LCC14中所含分子数为NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCu与足量的S反应转移电子数为2NA | |
| B. | 46g有机物C2H6O中含有共价键的数目为7NA | |
| C. | 在0.5L2mol•L-1的Na2CO3溶液中含CO32-的数目为NA | |
| D. | 10gD2O和H218O的混合物中含有的中子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素f位于第三周期第Ⅲ族 | |
| B. | 离子的半径大小为r(d2一)>r(e+) | |
| C. | 元素g的最高价氧化物对应水化物的酸性比h的强 | |
| D. | 由x、z组成的一种四原子化合物的电子式为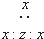 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
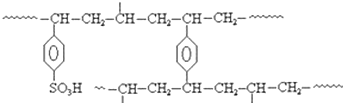
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,并用水洗涤量筒,洗涤液一并倒入烧杯中 | |
| D. | 如果不慎将酸粘到皮肤或衣物上,立即用较多的水冲洗,再用3%~5%的NaHCO3溶液来冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
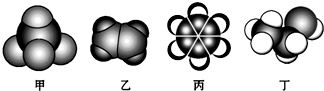
| A. | 甲中有少量乙杂质,可以通入到酸性高锰酸钾溶液中,洗气除杂 | |
| B. | 乙烷中有少量乙杂质,可以通入到溴水中,洗气除杂 | |
| C. | 丙中有少量苯酚杂质,可以先加浓溴水,然后静置,过滤除杂 | |
| D. | 丁有少量乙酸杂质,可以加少量浓硫酸并加热除杂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com