
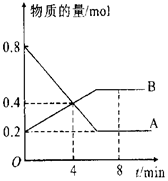
 在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题:
在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题:分析 (1)反应物在反应过程中物质的量在减少,生成物在反应过程中物质的量在增加,依据图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态;
(2)任何可逆反应中,反应到最后反应物的浓度不为零,反应物和生成物一定会共存;
(3)依据反应速率V=$\frac{△c}{△t}$计算,可逆反应在达到平衡前,正反应速率大于逆反应速率,达到平衡,正反应速率等于逆反应速率;
(4)图象分析随时间变化AB物质的量发生变化说明未达到平衡,8分钟时AB物质的量不变,说明反应达到平衡状态;依据AB消耗的物质的量之比计算得到化学方程式的计量数之比写出化学方程式;
(5)图象分析,A物质的量在减少为反应物,转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)反应物在反应过程中物质的量在减少,生成物在反应过程中物质的量在增加,图象分析,A物质的量在减少为反应物,B物质的量在增加为生成物,物质的量不变化说明反应达到平衡状态,
故答案为:A;
(2)可逆反应是指在同一条件下,既能向生成物方向进行,同时又能向反应物方向进行的反应,任何可逆反应中,反应到最后反应物的浓度不为零,图象分析A、B最终浓度不为零,反应物和生成物共存,为可逆反应,
故答案为:原因是反应到最后反应物的浓度不为零,且与生成物共存;
(3)反应开始至4min时,A物质的量变化=0.8mol-0.4mol=0.4mol,A的平均反应速率为V=$\frac{△c}{△t}$=$\frac{\frac{0.4mol}{4L}}{4min}$=0.025mol/(L•min),物质的量不变化说明反应达到平衡状态,4min时AB物质的量发生变化,说明未达到平衡,可逆反应在达到平衡前,正反应速率大于逆反应速率,所以此时V正>V逆,
故答案为:0.025mol/(L•min);>;
(4)图象分析可知,随时间变化AB物质的量发生变化说明未达到平衡,达到平衡状态,反应继续进行,正逆反应速率相等,各组分的浓度不再变化,8min时,AB物质的量不变,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol-0.2mol=0.6mol;B变化物质的量=0.5mol-0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2A?B,
故答案为:是;
(5)图象分析,A物质的量在减少为反应物,反应进行至4min时,A减少0.8mol-0.4mol=0.4mol,转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.4mol}{0.8mol}$=50%,
故答案为:50%.
点评 本题考查了化学平衡影响因素分析,化学反应速率计算应用,主要是图象分析判断,侧重考查了学生读图和运用化学反应原理解决问题的能力,题目难度中等.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | C≡O | C=O | C-H | H-H |
| 能量/kJ•mol-1 | 1074 | 803 | 413 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.
Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
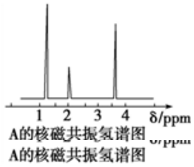
| A. | CH3CH2CH3 | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 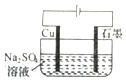 装置可实现:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 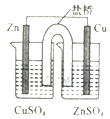 装置能构成锌铜原电池 | |
| C. | 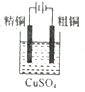 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于浓硫酸干燥氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验目的 | 实验操作 | |
| A | 区分苯和四氯化碳 | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡 |
| B | 证明溴乙烷中有溴原子 | 溴乙烷与NaOH水溶液共热,充分反应,冷却后加入硝酸银溶液 |
| C | 制取溴苯 | 在苯中加铁粉后再加溴水并振荡 |
| D | 除去苯中的甲苯 | 向混合物中加入酸性高锰酸钾溶液,然后分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2O2中只含有极性共价键,不含离子键 | |
| B. | 2NO2?N2O4的平衡常数K随温度升高而减小 | |
| C. | 向H2O2中加入Fe2(SO4)3后,B中颜色变浅 | |
| D. | H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| C. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| D. | 铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com