
下列实验现象描述正确的是
A.铜与氯气反应产生棕黄色的烟,加水后溶液呈蓝绿色
B.铁与稀硫酸反应,产生大量的气体,生成棕黄色溶液
C.氢气在氯气中燃烧产生苍白色烟雾,生成有刺激性气味的气体
D.钠在氧气中燃烧发出白色光,生成淡黄色固体
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:选择题
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是 ( )
| 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性: 2H++ SO42-+Ba2++2OH-=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性: 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
C | 铁与氯气反应:2Fe+3Cl2点燃2FeCl3 | 铁和碘单质反应:2Fe+3I12点燃2FeI3 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO- +CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)= c(NH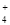 )=c(Cl-)
)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c (HCOO-)+ c(H+)>c(Na+)+c(OH-)
D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。
(1)Z离子的结构示意图是 。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是 ,其中含有的化学键有 。
(3)X与Y所形成的分子的电子式为 ,它比同主族其他元素的氢化物沸点高的原因是 。
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象: ___。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42- =BaSO4↓
B.用醋酸溶解水垢中的Mg(OH)2:2H+ + Mg(OH)2=Mg2++2H2O
C.工业上用氨水吸收二氧化硫:2OH- + SO2 = SO32- + H2O
D.在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3 - +2OH - = CaCO3↓+ CO32- + 2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:计算题
将镁、铝的混合物0.1 mol溶于100 mL 2 mol/L的H2S04溶液中,然后再滴加1 mol/L的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中,
n(Mg) =( )mol,V2=( )mL。
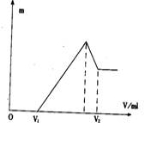
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13 +刚好沉淀完全,则滴入NaOH溶液的体积 )mL。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:选择题
将NaCl、KAl(SO4)2、FeCl2、Fe2(SO4)3、Mg(NO3)2五种溶液,只用一种试剂通过实验就能加以区别,这种试剂是
A.KSCN B.BaCl2 C.NaCl D.NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:选择题
(10分)25℃时,有下列五种溶液:
①0.1mol/L CH3COOH溶液 ②pH=13 NaOH溶液 ③ 0.05mol/L H2SO4
④0.1mol/L Na2CO3溶液 ⑤含有足量AgCl固体的饱和AgCl溶液
请根据要求填写下列空白:
(1)溶液④的pH 7(填“>、<、=”),其原因是 (用离子方程式表示)
(2)将该温度下a mL的溶液②与b mL的溶液③混合,所得混合溶液的pH=7,
则a:b =
(3)若溶液④和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,
该反应的离子方程式为
(4)在溶液⑤中分别放入:A.10mL蒸馏水;B.50mL 0.2 mol?L?1AgNO3溶液;C.60 mL 0.1mol?L?1AlCl3溶液;D.100mL 0.1 mol?L?1盐酸溶液。充分搅拌后,Ag+浓度最小的是 (填序号)
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高一上学期第三次考试化学试卷(解析版) 题型:选择题
河虾不宜与西红柿同食,主要原因是河虾中含+5价砷,西红柿中含有较多的维生素C,两者同食会产生有毒的+3价砷。据此,下列说法不正确的是
A.该反应中维生素C作还原剂
B.河虾与西红柿同食发生了氧化还原反应
C.该反应中砷元素被氧化
D.河虾与其它含维生素C较多蔬菜也不宜同食
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com