
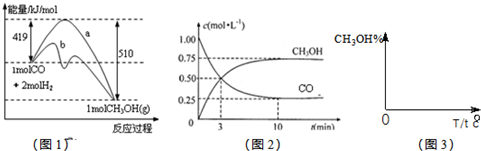
在密闭容器中,一定条件下,进行如下反应:
NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 一定条件 |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |

查看答案和解析>>
科目:高中化学 来源: 题型:
 联氨(N2H4)及其衍生物是重要的火箭燃料,N2H4与N2O4反应能放出大量的热.
联氨(N2H4)及其衍生物是重要的火箭燃料,N2H4与N2O4反应能放出大量的热.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
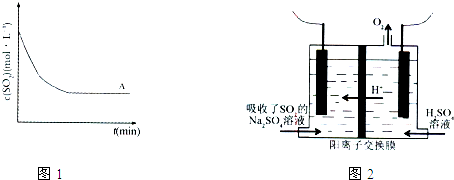
科目:高中化学 来源: 题型:阅读理解
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com