
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3,MnO4-被还原为Mn2+。
II.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32能将I2还原为I。
III.HNO2是具有氧化性的一元弱酸且AgNO2是一种难溶于水的白色化合物。
(1)兴趣小组同学拟利用铜片和某浓度的硝酸制备物质的量之比为1:1的NO和NO2的混合气体,请写出此反应的离子方程式___________________________;
(2)兴趣小组同学拟利用(1)产生的氮氧化物制备Ca(NO2)2,装置如图。

①装置A中导管末端接一玻璃球的作用是___________________________;
②装置B的作用是________________;
③若现有m mol NO2和n mol NO组成的混合气体进入装置C进行尾气处理,欲用a mol/L NaOH溶液吸收,至少需要a mol/L NaOH溶液的体积为____________升;
(3)兴趣小组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
A.KI(酸性)溶液 B.淀粉溶液
C.Na2S2O3溶液 D.酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是____________ (填字母);
②利用Ca(NO2)2的氧化性来测定其纯度,可选择的试剂是____________ (填字母);
(4)兴趣小组同学认为制备的Ca(NO2)2会混有Ca(NO3)2,能用来鉴别二者的试剂(_____)
A.测溶液的PH值 B.加硫酸铁(酸性)溶液
C.加硝酸银溶液 D.加淀粉碘化钾(酸性)溶液
【答案】 2Cu+2NO3-+6H+=2Cu2++NO+NO2+3H2O 增大气体与石灰乳的接触面积,加快反应速率 防止倒吸(或做安全瓶) ![]() D ABC A C
D ABC A C
【解析】本题考查实验方案设计与评价,(1)根据信息写出:Cu+H++NO3-→Cu2++NO2↑+NO↑+H2O, HNO3→NO2,化合价降低1价,HNO3-→NO,N的化合价降低3价,因为NO2和NO的物质的量比为1:1,因此化合价共降低4价,Cu→Cu2+化合价升高2价,最小公倍数为4,因此Cu的系数为2,离子反应方程式为:2Cu+2NO3-+6H+=2Cu2++NO↑+NO2↑+3H2O;(2)①玻璃球的目的是增大气体与石灰乳的接触面积,加快反应速率;②装置B进气管和出气管伸入广口瓶中长度相等,因此装置B的作用是安全瓶或防止倒吸;③发生反应是NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,根据产物n(N)=n(Na+)=n(NaOH)=n(NO)+n(NO2)=m+n,即V(NaOH)=(m+n)/aL;(3)①验证Ca(NO2)2的还原性,需要加入具有氧化性的物质,且有明显现象发生,因此选择试剂为酸性高锰酸钾溶液,测定Ca(NO2)2纯度,用酸性高锰酸钾溶液滴定Ca(NO2)2,即选D;②验证Ca(NO2)2的氧化性,需要加入还原性的物质,且有明显现象,因此选用的试剂是KI(酸性)溶液、淀粉,测定Ca(NO2)2纯度,需要用Na2S2O3滴定I2,因此选择ABC;(4)A、HNO2是一元弱酸,其Ca(NO2)2溶液显碱性,Ca(NO3)2溶液显中性,因此可以通过测溶液的pH进行鉴别,故A正确;B、硫酸铁与Ca(NO2)2、Ca(NO3)2都能生成沉淀CaSO4,现象相同,无法鉴别,故B错误;C、根据信息,AgNO2是一种难溶于水的白色化合物,而AgNO3易溶于水,因此加入AgNO3溶液,可以鉴别Ca(NO2)2和Ca(NO3)2,故C正确;D、HNO2具有氧化性,NO3-在酸性条件下具有氧化性,都能使淀粉碘化钾(酸性)溶液变蓝,因此不能鉴别Ca(NO2)2和Ca(NO3)2,故D错误。


科目:高中化学 来源: 题型:
【题目】室温下,向100 mL一定浓度的草酸(H2C2O4)溶液中加入0.1mol·L-1NaOH 溶液,溶液的pH随NaOH溶液体积的变化曲线如图所示。下列有关说法正确的是

A. a点溶液的pH=2,草酸溶液的浓度为0.005 mol ·L-1
B. b点对应溶液中:c(Na+)>c(HC2O4-)>c(OH-)>c(C2O42-)
C. b→c段,反应的离子方程式为HC2O4- +OH-=C2O42-+H2O
D. c→d段,溶液中C2O42-的水解程度逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,已知其中含有Cl为1.8 mol,Na+为2 mol,Mg2+为0.5 mol,则![]() 的物质的量浓度为
的物质的量浓度为
A.0.6 mol /L B.0.7 mol /L C.1.2 mol /L D.1.0 mol /L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2+O22SO3△H<0是工业上接触法制硫酸的重要反应.下列关于该反应的说法不正确的是( )
A. 增加O2的浓度提高SO2的转化率
B. 降低温度能加快反应的速率
C. 利用该反应放出的热量对SO2、O2预热
D. 即使增大压强也不能使SO2全部转化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:

(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F. 乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是______________________________________________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极: __________________,总反应: ________________________________。
当电路中转移0.25 mol电子时,消耗负极材料的质量为________________ (Zn的相对原子质量65)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为________________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有________。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为____________ g,要完成本实验该同学应称出____________ g NaOH。
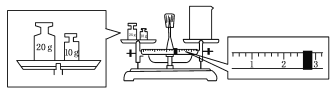
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 生成氢气的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应物的物质的量是2.0mol,经过4min后,它的物质的量变成了1.68mol,则在这4min内它的反应速率是( )
A. 无法确定 B. 0.08 molL﹣1min﹣1
C. 0.32 molL﹣1min﹣1 D. 0.06 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(K2NCONH2)的化学能直接转化为电能,并生成对环境无害物质的装罝;同时利用此装置的电能在铁上镀铜,下列说法中正确的是

A. H+透过质子交换膜由右向左移动
B. 铜电极应与X相连接
C. M电极反应式:H2NCONH2+H2O-6e-== CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,铁电极增重16 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com