
| A. | 溶液为紫色 | B. | 最后溶液变为蓝色 | ||
| C. | 最后溶液褪色 | D. | 有气泡产生 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
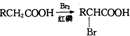 RCH2COOH$→_{红磷}^{Br_{2}}$
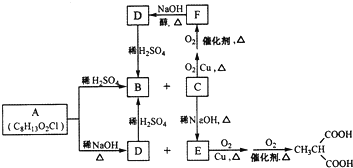
RCH2COOH$→_{红磷}^{Br_{2}}$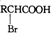 请以2一甲基丙醇和甲醇为原料,设计制备有
请以2一甲基丙醇和甲醇为原料,设计制备有查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径D>E>C>B | |
| B. | A、C、D、E四种元素形成的化合物溶于水一定显酸性 | |
| C. | C、D形成的化合物是离子化合物,只含有离子键 | |
| D. | A、C形成的化合物只有氧化性没有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.| 实验 | pH | 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是指常温常压下,2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ | |
| B. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ | |
| C. | 是指标准状况下,2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ | |
| D. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用浓硫酸干燥H2、NH3、Cl2等气体 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 氨水、铵盐受热都易发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com