
| A、酸性:H2SiO3>H2CO3 |
| B、碱性:Mg(OH)2>Al(OH)3 |
| C、稳定性:SiH4>PH3 |
| D、原子半径:N>C |


科目:高中化学 来源: 题型:
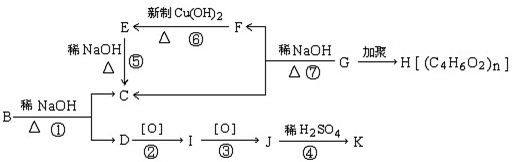
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子p电子总数与s电子总数相等,且不与A元素在同一周期 |
| C原子所有轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
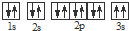 ,违背了
,违背了查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33% | B、40% |
| C、50% | D、67% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应属于置换反应 |
| B、C是还原剂,发生还原反应 |
| C、SiO2是氧化剂,在反应中还原 |
| D、氧化还原反应的实质是电子的转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com