
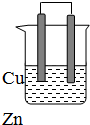
 由铜、锌和稀硫酸组成的原电池中:
由铜、锌和稀硫酸组成的原电池中: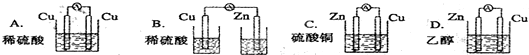
分析 (1)铜、锌、稀硫酸原电池中,锌易失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应;
(2)铜、锌、稀硫酸原电池中,锌易失电子溶解发生氧化反应,铜作正极,正极上氢离子得电子生成氢气;
(3)根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:(1)铜、锌、稀硫酸原电池中,锌易失电子发生氧化反应而作负极,电极反应式为:Zn-2e-═Zn2+,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:负;Zn-2e-═Zn2+;正;2H++2e-=H2↑;
(2)铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,所以铜极上可以观察到有气泡产生;锌易失电子发生氧化反应而作负极,电极反应式为:Zn-2e-═Zn2+,所以锌极可以观察到锌片逐渐溶解;
故答案为:有气泡产生;锌片逐渐溶解;
(3)A.两个电极材料相同且不能自发的进行氧化还原反应,故A错误;
B.没有形成闭合回路,故B错误;
C.符合原电池的构成条件,故C正确;
D.乙醇不是电解质溶液且不能自发的进行氧化还原反应,故D错误;
故选C.
点评 本题考查了原电池原理以及形成原电池的条件,明确正负极的判断方法、正负极上电极反应即可解答,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓硫酸共热制乙醚 | B. | 乙醇使酸性高锰酸钾褪色 | ||
| C. | 乙醇与氧气点燃生成水和二氧化碳 | D. | 乙醇与浓硫酸共热制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极质量减少 | |
| B. | 放电一段时间后,溶液的pH值减小 | |
| C. | 充电时,阳极反应:PbSO4+2e-=Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 37Cl与39K具有相同的中子数 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 | |
| C. | H3O+与OH-具有相同的质子数和电子数 | |
| D. | O22-与S2-具有相同的质子数和电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②④⑤ | C. | ②⑤⑥ | D. | ①③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com