
下列叙述不正确的是:
A.用反应热数据的大小判断不同反应反应速率的快慢
B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.用平衡常数的大小判断化学反应可能进行的程度
A
【解析】
试题分析:在相同的外界条件下不同的物质的反应热不同,反应速率可能不同;同一物质在不同的条件下,反应也有快有慢,因此不能用反应热数据的大小判断不同反应反应速率的快慢。符合题意。正确。B.盐的水解规律是:有弱才水解,谁弱谁水解,谁强显谁性。越弱越水解。都强不水解。所以可根据用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小。不符合题意。错误。C.盖斯定律可知:反应热与反应的途径无关,而只与物质的开始状态与终了状态有关。因此可利用盖斯定律不仅能够直接测量某些反应的反应热,也可计算某些难以直接测量的反应焓变。不符合题意。错误。D.对于可逆反应来说,化学平衡常数只与温度有关而与加入的物质的多少无关。化学平衡常数就是当可逆反应达到平衡状态时各生成物浓度幂指数的乘积与个反应物浓度幂指数的乘积的比。化学平衡常数越大,生成物在平衡混合物中的含量就越高,反应物的转化率就越大。因此可用平衡常数的大小判断化学反应可能进行的程度。不符合题意。错误。
考点:考查盖斯定律、平衡常数及PH、反应热等的应用的知识。


科目:高中化学 来源:2015届浙江省宁波市八校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,中和等物质的量浓度等体积的醋酸和盐酸溶液,消耗氢氧化钠溶液体积相等
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快
查看答案和解析>>
科目:高中化学 来源:2015届河南许昌市五校高二下学期第一次联考化学试卷(解析版) 题型:实验题
某同学用下列装置(固定、加热仪器和橡胶管已经省略)进行有关气体制取及其相关实验的探究,回答下列问题.
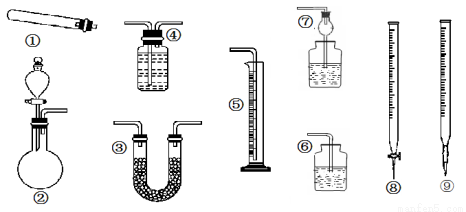
(1)若用装置①制取NH3,其反应的化学方程式为 ;多余的氨气应选用 装置吸收。(填装置序号,下同)
(2)若用装置②制乙炔,其反应的化学方程式为 ;要测定生成乙炔的体积,则必须选择的装置是 ,因制取的乙炔常含有杂质,若要除去杂质,所选装置中应盛放的试剂为: 。
(3)若用装置②制取乙烯,少了一种重要仪器 _。
(4)若用0.01mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸溶液,酸性高锰酸钾溶液应装在装置 中。
查看答案和解析>>
科目:高中化学 来源:2015届河南许昌市五校高二下学期第一次联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗数,下列叙述正确的是( )
A. 7.8gNa2O2固体中阴、阳离子数之和一定为0.3NA
B. 室温下,14.0g乙烯和丁烯的混合气体中含有的氢原子数目为NA
C.0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA
D.常温常压下,1mol甲基所含的电子总数为7 NA
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高二上学期期末检测化学试卷(A)(解析版) 题型:填空题
(10分)工业上制备BaCl2的工艺流程图如图:
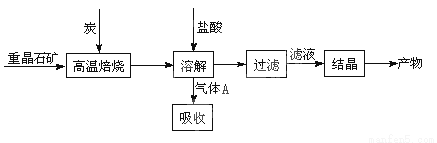
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
A.Na2S溶液的pH比NaHS溶液pH小
B.两溶液中含有的离子种类不同
C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等
D.两溶液中加入NaOH固体,c(S2-)都增大
E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+)
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,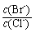 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)反应C(s) + CO2(g) 2CO(g)的ΔH =
2CO(g)的ΔH =
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是: (只要求答一条)。
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高二上学期期末检测化学试卷(A)(解析版) 题型:选择题
反应CO(g)+NO2(g)  CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则
CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则
A.若增大CO浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(NO2) D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高二上学期期末检测化学试卷(A)(解析版) 题型:选择题
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C.在氯化银沉淀溶解平衡体系中,加入碘化钠固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
某学生欲完成反应Cu+H2SO4===CuSO4+H2↑而设计了下列四个实验,你认为可行的是

查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:实验题
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量
步骤如下并填写下列空白:
(1)将10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250mL。量取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,作被测试样。此过程中需要用到的定量仪器 。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请完成该反应方程
___MnO4- + __H2O2 + ___H+ → ___Mn2+ + __H2O + __ _____
(3) 滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是
(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____(填“偏高”“偏低”“不变”)。
Ⅱ.探究过氧化氢的性质
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、淀粉碘化钾溶液、二氧化锰,实验仪器及用品可自选。)
请将他们所选的实验试剂和实验现象填入下表:
实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
探究氧化性 |
|
|
探究不稳定性 |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com