
| A、原子序数由大到小的顺序为Z<Y<X |
| B、Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C、3种元素的气态氢化物中Z的气态氢化物最稳定 |
| D、原子半径由大到小的顺序为Z>Y>X |


科目:高中化学 来源: 题型:
| A、弱碱溶于水后能促进水的电离 |
| B、盐溶于水后一定能促进水的电离 |
| C、任何条件下,只要pH>7,溶液就一定显碱性 |
| D、任何条件下,只要c(H+)>c(OH-),溶液就一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
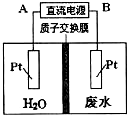 用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的( )
用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的( )| A、电源正极为A,电解过程中有气体放出 |
| B、电解时H+从质子交换膜左侧向右侧移动 |
| C、电解过程中,右侧电解液pH保持不变 |
| D、电解池一侧生成5.6g N2,另一侧溶液质量减少l8g |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、化学催化比酶催化的效果好 |
| B、使用不同催化剂可以改变反应的能耗 |
| C、反应物的总能量低于生成物的总能量 |
| D、使用不同催化剂可以改变反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78Se和80Se互为同素异形体 |
| B、78Se和80Se互为同位素 |
| C、78Se和80Se分别含有34个中子和46个质子 |
| D、78Se和80Se的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
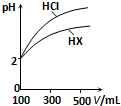 水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com