
分析 (1)含有弱离子的盐能发生水解;
(2)这几种物质中,能和强碱、强酸反应的物质为弱酸的酸式盐,HCO3-电离程度小于水解程度,其溶液呈碱性;
(3)向氨水中加入氯化铵抑制一水合氨电离;向NH3•H2O中加入水稀释,导致氢氧根离子的浓度减小,所以氢离子的浓度变大;
(4)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,根据溶液酸碱性结合电荷守恒判断离子浓度大小;
(5)酸对水的电离有抑制作用,据KW计算出水电离出来的氢氧根离子浓度,水电离出的氢离子和氢氧根离子浓度相等,据此求算;
(6)该溶液中钠离子与含有C原子的微粒存在物料守恒,钠离子浓度和含有C原子的微粒的浓度之和的比为3:2,碳酸根离子水解生成碳酸氢根离子、碳酸氢根离子水解生成碳酸,所以含有C原子的微粒有CO32-、HCO3-、H2CO3;
(7)若将③HCl、④NH3•H2O溶液按1:2体积混合,得到等物质的量浓度相等的氯化铵和一水合氨,以氨水的电离为主,溶液后呈碱性,由此分析解答;
解答 解:(1)含有弱离子的盐能发生水解,碳酸钠和碳酸氢钠都是含有弱离子的盐,能发生水解,故选:①②;
(2)这几种物质中,能和强碱、强酸反应的物质是碳酸氢钠,HCO3-水解程度大于电离程度,但程度都较小,溶液呈碱性,溶液中HCO3-和水都电离生成氢氧根离子,则溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+);
(3)向氨水中加入氯化铵,溶液中铵根离子浓度增大,抑制一水合氨电离,氢氧根离子浓度减小,所以$\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$的值增大,向NH3•H2O中加入水稀释,导致氢氧根离子的浓度减小,所以氢离子的浓度变大,故答案为:增大;增大;
(4)氯化铵为强酸弱碱盐,其溶液呈酸性,要使盐酸和氨水溶液呈中性,则氨水应该稍微过量,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Cl-)=c(NH4+),中性溶液中水的电离程度很小,所以离子浓度大小顺序是c(Cl-)=c(NH4+)>c(OH-)=c(H+),故答案为:小于;c(Cl-)=c(NH4+)>c(OH-)=c(H+);
(5)取10mL溶液0.5mol/L的盐酸,加水稀释到500mL,c(H+)=$\frac{0.5mol/L×0.01L}{0.5L}$=0.01mol/L,据常温下水的离子积常数可知,c(OH-)水=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,所以水电离出来的氢离子浓度为10-12mol/L;
故答案为:10-12mol/L;
(6)该溶液中钠离子与含有C原子的微粒存在物料守恒,钠离子浓度和含有C原子的微粒的浓度之和的比为3:2,碳酸根离子水解生成碳酸氢根离子、碳酸氢根离子水解生成碳酸,所以含有C原子的微粒有CO32-、HCO3-、H2CO3,所以存在的物料守恒为2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),
故答案为:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3);
(7)若将③HCl、④NH3•H2O溶液按1:2体积混合,得到等物质的量浓度相等的氯化铵和一水合氨,以一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(Cl-)>c(NH3•H2O),溶液显示碱性,则溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+).
点评 本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性结合守恒思想分析解答,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
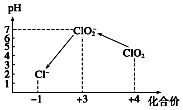 ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
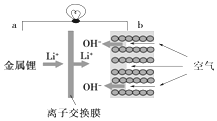
| A. | a为电源正极 | B. | 电流从a流向b | ||
| C. | 离子交换膜为阳离子交换膜 | D. | b电极处,O2失电子生成OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、I-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、NH4+可以大量共存 | |
| C. | 该溶液中,Fe2+、Fe3+、Cl-、NO3-可以大量共存 | |
| D. | 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol O2完全反应时,转移的电子数为0.4NA | |
| B. | 用惰性电极点解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| D. | 1mol 葡萄糖与足量的钠反应能产生2.5mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
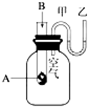 为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
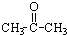 ③CH3CH2Br④
③CH3CH2Br④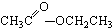 ⑤
⑤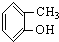 ⑥
⑥ ⑦
⑦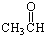 ⑧
⑧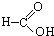 ⑨
⑨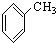 ⑩
⑩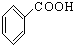
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com