
(14分)(1).将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为________。
(2).同温同压下,质量相同的五种气体: ① CO2 ② H2 ③ O2 ④ CH4 ⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________;
密度由大到小的顺序是_________________________________。
(3).VmL Al2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是(单位为mol/L)______________。
(4).有一质量为mg,相对分子质量为M的某种强碱M (OH)2,在一定温度下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为________,溶质的质量分数为________。
(1)1:1;3:1
(2) ②④③①⑤;⑤①③④②;
(3)125a/9v mol/L
(4)2000m/MV mol/L;m/pv
【解析】
试题分析:(1)质量比为14 :15的N2和NO,则物质的量之比为14/28:15/30=1:1;根据化学式的不同,二者的N原子数之比是2:1;
(2)质量相同时,摩尔质量小的气体的物质的量大,相同条件下占有的体积大,所以所占的体积由大到小的顺序是②④③①⑤;质量相同时,体积大的密度小,所以密度由大到小的顺序是⑤①③④②;
(3)VmL Al2(SO4)3溶液中含Al3+ ag,,则铝离子的浓度是1000a/27/Vmol/L=1000a/27Vmol/L,所以硫酸根离子的浓度是铝离子浓度的3/2倍,即500a/9Vmol/L;取V/4mL溶液稀释到VmL,溶液的体积扩大为原来的4倍,溶质的物质的量不变,所以硫酸根离子的浓度变为原来的1/4,所以稀释后溶液中的SO42-的物质的量浓度是500a/9Vmol/L/4=125a/9v mol/L;
(4)mg强碱的物质的量是m/Mmol,则氢氧根离子的物质的量是该强碱物质的量的2倍,即2m/Mmol,溶液体积是VmL,所以氢氧根离子的物质的量浓度是2m/Mmol/(V×10-3)L=2000m/MVmol/L;该溶液的质量是ρg/cm3×VmL=ρVg,所以溶液中溶质的质量分数是m/ρV。
考点:考查物质中微粒数的判断,离子浓度的计算,溶液的物质的量浓度与质量分数的计算


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高二上学期期中联考化学试卷(解析版) 题型:选择题
在H2O中加入等物质的量的Ag+、Na+、Ba2+、NO3-、SO42-、Cl-,该溶液在惰性电极的电解 槽中通电片刻后,氧化产物和还原产物的质量比是
A.1:2 B.8:1 C.35.5:108 D.108:35.5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:实验题
(6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_______________________________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是________________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1________ΔH(填“<”、“>”或“=”),理由是__________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是。
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是 ( )。

A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 滴加用稀硝酸酸化的硝酸银溶液 | 生成白色沉淀 | 原溶液中有Cl― |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
A.0.01 mol·L-1的蔗糖溶液 B.0.01 mol·L-1的CaCl2溶液
C.0.02 mol·L-1的NaCl溶液 D.0.02 mol·L-1的CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体________g。
Ⅱ.测定中和热的实验装置如图所示
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3 kJ/mol):________ 。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
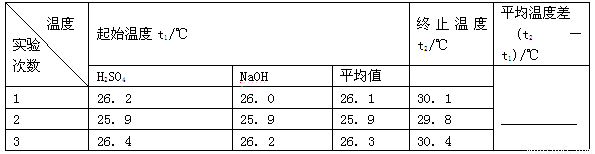
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=________(取小数点后一位)。
③上述实验结果的数值与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
常温下,①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。有关上述溶液的比较中,不正确的是
A.水电离的c(H+):①=②=③=④
B.将②、③溶液混合后,pH=7,消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向溶液中加入100mL水后,溶液的pH:③>④>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com