

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 Ag£«£Øaq£©£«Cl££Øaq£©£¬Čō°ŃAgCl·Ö±š·ÅČė¢Ł100mL0.1mol/LNa2SO4ČÜŅŗÖŠ£»¢Ś100mL0.1mol/L NaClČÜŅŗÖŠ£»¢Ū100mL0.1mol/L AlCl3ČÜŅŗÖŠ£»¢Ü100mL0.1mol/L MgCl2ČÜŅŗÖŠ”£½Į°čŗóŌŚĻąĶ¬µÄĪĀ¶ČĻĀAg£«ÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ£ŗ
Ag£«£Øaq£©£«Cl££Øaq£©£¬Čō°ŃAgCl·Ö±š·ÅČė¢Ł100mL0.1mol/LNa2SO4ČÜŅŗÖŠ£»¢Ś100mL0.1mol/L NaClČÜŅŗÖŠ£»¢Ū100mL0.1mol/L AlCl3ČÜŅŗÖŠ£»¢Ü100mL0.1mol/L MgCl2ČÜŅŗÖŠ”£½Į°čŗóŌŚĻąĶ¬µÄĪĀ¶ČĻĀAg£«ÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ£ŗ| A£®¢Ł£¾¢Ś£¾¢Ü£¾¢Ū | B£®¢Ś£¾¢Ł£¾¢Ü£¾¢Ū | C£®¢Ü£¾¢Ū£¾¢Ś£¾¢Ł | D£®¢Ł£¾¢Ü£¾¢Ū£¾¢Ś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®AgCl>AgI>Ag2CrO4 | B£®AgCl> Ag2CrO4>AgI |
| C£®Ag2CrO4> AgCl> >AgI | D£®Ag2CrO4> AgI> AgCl |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
| A£®Į½ÖÖÄŃČÜŃĪµē½āÖŹ£¬ĘäÖŠKspŠ”µÄČܽā¶ČŅ»¶ØŠ” |
| B£®Ļņŗ¬ÓŠAgCl¹ĢĢåµÄČÜŅŗÖŠ¼ÓČėŹŹĮæµÄĖ®Ź¹AgClČܽāÓÖ“ļµ½Ę½ŗāŹ±£¬AgClµÄČܶȻż²»±ä£¬ĘäČܽā¶ČŅ²²»±ä |
| C£®½«ÄŃČܵē½āÖŹ·ÅČė“æĖ®ÖŠ£¬Čܽā“ļµ½Ę½ŗāŹ±£¬µē½āÖŹĄė×ÓµÄÅØ¶ČµÄ³Ė»ż¾ĶŹĒøĆĪļÖŹµÄČܶȻż |
| D£®ČÜŅŗÖŠ“ęŌŚĮ½ÖÖæÉŅŌÓėĶ¬Ņ»³Įµķ¼ĮÉś³É³ĮµķµÄĄė×Ó£¬ŌņKspŠ”µÄŅ»¶ØĻČÉś³É³Įµķ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®25”ćCŹ±£¬±„ŗĶMg(OH)2ČÜŅŗÓė±„ŗĶMgF2ČÜŅŗĻą±Č£¬Ē°ÕßµÄc(Mg2+)“ó |
| B£®25”ćCŹ±£¬ŌŚMg(OH)2µÄŠü×ĒŅŗ¼ÓČėÉŁĮæµÄNH4Cl¹ĢĢ壬c(Mg2+)Ōö“ó |
| C£®25”ćCŹ±£¬Mg(OH)2¹ĢĢåŌŚ20mL0.01 mol”¤L-1°±Ė®ÖŠµÄKsp±ČŌŚ20mL0.01mol”¤L-1NH4ClČÜŅŗÖŠµÄKspŠ” |
| D£®25”ćCŹ±£¬ŌŚMg(OH)2µÄŠü×ĒŅŗÖŠ¼ÓČėNaFČÜŅŗŗó£¬Mg(OH)2²»æÉÄÜ×Ŗ»ÆĪŖMgF2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 4Fe(OH)3£«8OH££«_____”£
4Fe(OH)3£«8OH££«_____”£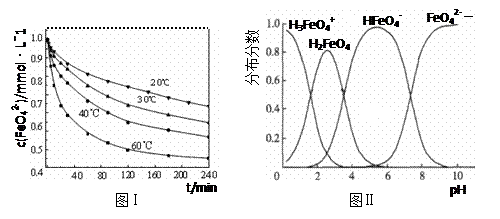
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
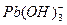 Ӣ
”¢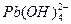 ,ø÷ŠĪĢ¬µÄÅØ¶Č·ÖŹż¦ĮĖęČÜŅŗpH±ä»ÆµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾:
,ø÷ŠĪĢ¬µÄÅØ¶Č·ÖŹż¦ĮĖęČÜŅŗpH±ä»ÆµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾: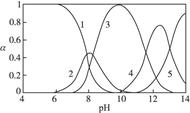
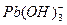 ,5±ķŹ¾
,5±ķŹ¾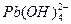
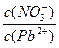 ___________2(Ģī”°£¾”±”°=”±»ņ”°£¼”±);ĶłøĆČÜŅŗÖŠµĪČėĀČ»Æļ§ČÜŅŗŗó,
___________2(Ģī”°£¾”±”°=”±»ņ”°£¼”±);ĶłøĆČÜŅŗÖŠµĪČėĀČ»Æļ§ČÜŅŗŗó, 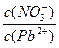 Ōö“ó,æÉÄܵÄŌŅņŹĒ_____________”£
Ōö“ó,æÉÄܵÄŌŅņŹĒ_____________”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
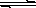 Cu2£«£Øaq£©£«2OH££Øaq£©£¬³£ĪĀĻĀĘäKsp£½2”Į10£20Ōņ£ŗ
Cu2£«£Øaq£©£«2OH££Øaq£©£¬³£ĪĀĻĀĘäKsp£½2”Į10£20Ōņ£ŗ
| ½šŹō Ąė×Ó | pH | |
| æŖŹ¼³Įµķ | ĶźČ«³Įµķ | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
 A.H2O2 B.KMnO4 C.HNO3 D.Cl2
A.H2O2 B.KMnO4 C.HNO3 D.Cl2²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®ÓŠAgCl³ĮµķĪö³ö”””” | B£®ĪŽAgCl³ĮµķĪö³ö |
| C£®ÓŠ³ĮµķĪö³ö£¬µ«²»ŹĒAgCl | D£®ĪŽ·ØČ·¶ØŹĒ·ńÓŠ³ĮµķĪö³ö |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com