
| A. | 烧杯 | B. | 容量瓶 | C. | 漏斗 | D. | 玻璃棒 |
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅元素在自然界里均以化合态存在 | |
| B. | SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2=Si+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
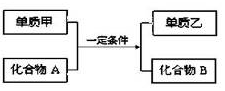
 ,在这个反应中作氧化剂的是H2O(填化学式)
,在这个反应中作氧化剂的是H2O(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

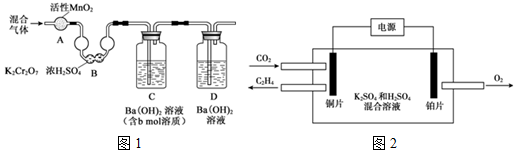
| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 通入氯化氢气体 | ||
| C. | 加入适量的氢氧化钠溶液 | D. | 加入固体AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL | B. | 5 mL | C. | 大于5 mL | D. | 小于5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热还原法 | B. | 分解法 | C. | 电解法 | D. | 富集法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com