
下列说法正确的是( )
-A.-常温下,4.4g N2O和CO2的混合气体中所含有的原子数约为0.3×6.02×l023
-B.-含1 mol FeCl3的饱和溶液完全与水反应生成1mol Fe(OH)3胶体粒子
-C.-标准状况下,1mol任何物质的体积都大约为22.4L
-D.-根据分散系的稳定性大小将分散系分为胶体、溶液和浊液
考点:-物质的量的相关计算;分散系、胶体与溶液的概念及关系.
分析:-A.N2O和CO2的摩尔质量均为44g/mol,平均摩尔质量为44g/mol,根据n= 计算混合气体总物质的量,再根据N=nNA计算原子总数;
计算混合气体总物质的量,再根据N=nNA计算原子总数;
B.胶体粒子是大量氢氧化铁的聚合体;
C.应描述为“标准状况下,1mol任何气体的体积都大约为22.4L”;
D.根据分散质微粒直径大小将分散系分为溶液、胶体、浊液.
解答:-解:A.N2O和CO2的摩尔质量均为44g/mol,平均摩尔质量为44g/mol,4.4g混合气体总物质的量为 =0.1mol,均为3原子分子,含有原子总数为0.1mol×3×6.02×l023mol﹣1=0.3×6.02×l023,故A正确;
=0.1mol,均为3原子分子,含有原子总数为0.1mol×3×6.02×l023mol﹣1=0.3×6.02×l023,故A正确;
B.Fe(OH)3胶体粒子胶体粒子是大量氢氧化铁的聚合体,含1mol FeCl3溶质的溶液形成胶体后,胶体粒子远远小于1mol,故B错误;
C.应描述为“标准状况下,1mol任何气体的体积都大约为22.4L”,对于液态、固体体积不一定,故C错误;
D.根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),故D错误,
故选A.
点评:-本题考查物质的量有关计算、分散系等,注意基础知识的积累与理解,题目难度不大,有利于基础知识的巩固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为()
A. V(NH3)=0.0010mol•L﹣1•S﹣1 B. V(O2)=0.0010 mol•L﹣1•S﹣1
C. V(NO)=0.010 mol•L﹣1•S﹣1 D. V(H2O)=0.045 mol•L﹣1•S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A有稳定性好、抗氧化能力强的特点,其结构如图 .分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B(
.分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B(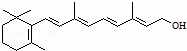 )和C.经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生
)和C.经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生
完成下列填空:
(1)化合物B能发生下列哪种类型的反应
a.取代反应b.加成反应c.缩聚反应d.氧化反应
(2)化合物C能经下列反应得到G(分子式为C8H6O2,分子内含五元环).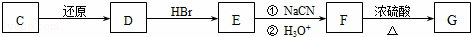
已知:ROOH RCH2OH RX
RCH2OH RX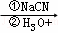 RCOOH
RCOOH
化合物C的结构简式为 .
(3)反应F→G的化学方程式为
(4)化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意三种的结构简式、、.
查看答案和解析>>
科目:高中化学 来源: 题型:
利用“化学蒸气转移法”制备TaS2晶体,某温度下的2L恒容密闭容器中加入一定量 的 I2(g)和TaS2(s)发生如下反应:TaS2(s)+2I2(g)⇌TaI4(g)+S2(g)△H=a kJ•mol﹣1 (Ⅰ)达平衡时,TaS2(s)、I2(g)、TaI4(g)、S2(g)的物质的量分别为3mol、2mol、2mol、2mol.
(1)反应(Ⅰ)的平衡常数表达式K=
(2)若该温度下该容器中某时刻TaS2(s)、I2(g)、TaI4(g)、S2(g)的物质的量分别为2mol、2mol、4mol、4mol,则该时刻平衡向 (填“正反应”或“逆反应”)移动,v正 v逆(填“>”、“=”或“<”).
(3)在不同温度下,该反应的平衡常数K如下表:
| 温度/℃ | 40 | 80 | 200 |
| 平衡常数K | 1 | 1.5 | 4 |
该反应的△H 0(填“>”、“=”或“<”).
(4)40℃时,向该恒容密闭容器中加入2mol I2(g)和4mol TaS2(s),I2(g)的平衡转化率为 写出计算过程,结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
-A.-同种胶体带同种电荷,相互排斥,是胶体稳定的主要原因
-B.-生石灰与水混合的过程只发生物理变化
-C.-O3是由3个氧原子构成的化合物
-D.-可用丁达尔效应区分溶液与胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
-A.-将氯化铁饱和溶液逐滴滴入氢氧化钠稀溶液中,边滴边搅拌,可获得氢氧化铁胶体
-B.-不能用乙醇萃取碘水中的碘是因为碘在水中溶解度比在乙醇中大
-C.-实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水
-D.-浓硫酸不慎溅到皮肤上,应该立即用大量水冲洗,然后涂上稀NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃、101kPa的条件下,同质量的CH4和A气体的体积之比是11:4,则A的摩尔质量为 .
在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为 mol/L,SO42﹣的物质的量浓度为 mol/L.
(3)将5.3gNa2CO3溶于水配成1L溶液,要使Na+浓度变为0.2mol/L,需要加入NaCl固体 g
(4)实验测得CO和O2混合气体的密度是氢气的15.5倍,其中氧气的体积分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子的检验方法中正确的是( )
|
| A. | 某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl﹣ |
|
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42﹣ |
|
| C. | 某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
|
| D. | 某溶液加KOH溶液生成红褐色沉淀,说明原溶液中有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用NaOH固体配制480mL 1.0mol/L的NaOH溶液,请回答下列问题:
(1)应称取NaOH固体的质量 g
(2)实验仪器除了托盘天平、药匙、烧杯、玻璃棒外,还应有
(3)容量瓶上需标有以下五项中的 (序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)使用容量瓶前必须进行的一步操作是 .
(5)配制时,其正确的操作顺序是
A、用30mL水洗涤烧杯2﹣3次,洗涤液均转入容量瓶,振荡
B、用托盘天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切
F、继续往容量瓶内小心加水,直到液面接近刻度线1﹣2cm处
(6)下列配制的溶液浓度偏大的是
A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、未洗涤溶解NaOH的烧杯
D、定容时俯视刻度线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com