
| A. | H2SO4 | B. | H20 | C. | HCl | D. | Na2C03 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 实验室可用燃着的酒精灯去点燃另一只酒精灯 | |
| B. | 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸 | |
| C. | 不慎把浓硫酸洒在皮肤上,要立即用NaOH溶液冲洗 | |
| D. | 盛放浓盐酸的试剂瓶上要贴上如图的标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol| A. | CO的燃烧热为283 kJ | |
| B. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=+452 kJ/mol | |
| C. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| D. | CO(g)与Na2O2(s)反应生成1molNa2CO3(s)时放出509kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中滴入盐酸:H++OH-=H2O | |
| B. | 向澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ⅰ操作 | Ⅱ结论 | |
| A | 滴加用硝酸酸化的BaC12溶液生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置.下层溶液显紫色 | 原溶液中有I- |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
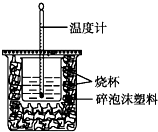 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质碳具有还原性 | |
| B. | 木炭燃烧时吸收大量的热 | |
| C. | 用活性炭可除去硬水中的氯化钙杂质 | |
| D. | 金刚石、石墨都是由碳原子构成的,都很硬 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com