
 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂.| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
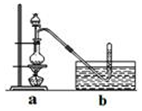
分析 本题是利用甲醇与浓盐酸反应制备CH3Cl,涉及具体的制备过程是先在干燥的HCl气流中加热ZnCl2晶体得到无水ZnCl2,再将无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶并滴加一定量的甲醇,经加热后会有CH3Cl生成,因CH3Cl中混有挥发出的HCl及甲醇,选择排水法收集生成的气体的同时还可以除杂,另外还探究了的稳定性及含有CH3Cl尾气的处理;
Ⅰ.(1)因ZnCl2晶体直接加热时,因Zn2+水解,如果直接加热最终得到的是Zn(OH)2,因此要用浓盐酸或HCl气体抑制其水解的同时加热;
(2)当有两种反应物参加反应时,可通过提高一种反应物的量提高另一种反应物的转化率;
(3)因反应混合物中的盐酸和甲醇均易挥发,生成的CH3Cl中会混有挥发出的杂质,同时CH3Cl难溶于水,选用排水法收集的同时还会有除杂的作用;
Ⅱ.(1)如果CH3Cl能被酸性高锰酸钾氧化,则酸性高锰酸钾溶液本身会褪色,同时可能会生成CO2和Cl2,因此要注意尾气的处理;
(2)CH3Cl经过酸性高锰酸钾的洗气瓶会被氧化成CO2和Cl2,生成的Cl2可选择Na2SO3溶液,利用氯气的氧化性,将Na2SO3氧化为Na2SO4;
(3)因CH3Cl易溶于乙醇和丙醇等有机溶剂,因此的尾气可选择有机溶剂吸收;
(4)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:Ⅰ.(1)在加热ZnCl2晶体时可选择通HCl气体抑制其水解,故答案为:在干燥的HCl气氛中加热;
(2)为了提高甲醇的利用率,可以适当增加盐酸的量,故答案为:增大盐酸的量以提高甲醇的转化率;
(3)因CH3Cl中混有易溶于水的杂质气体,用排水法可以即除杂又可收集,故答案为:CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体;
Ⅱ.(1)如果CH3Cl能被强氧化剂酸性高锰酸钾氧化,可选择先通过盛有水的洗气瓶除去可能混合有的HCl和甲醇,再通过盛有的酸性高锰酸钾洗气瓶,溶液的紫色会褐去,最后通过盛Na2SO3的洗气瓶吸收生成的氯气防污染,故答案为:BAC;A紫色褪去;
(2)酸性高锰酸钾氧化CH3Cl会生成CO2和Cl2,同时自身被还原成Mn2+,发生反应的离子方程式为10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O,生成的氯气经过Na2SO3的洗气瓶会氧化Na2SO3为Na2SO4,发生反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+H+,
故答案为:10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32-+Cl2+H2O=SO42-+2Cl-+H+;
(3)CH3Cl易溶于乙醇和丙醇等有机溶剂,可选择酒精吸收CH3Cl的尾气,故答案为:乙醇;
(4)a.锥形瓶洗净后未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(标准)不变,故a错误;
b.酸式滴定管用蒸馏水洗净后未用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(标准)偏大,故b正确;
c.滴定过程中振荡锥形瓶时有液体溅出,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(标准)偏小,故c错误;
d.滴定终点时仰视读数,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(标准)偏大,故d正确;
故选bd.
点评 本题考查了甲醇和浓盐酸混合加热制一氯甲烷的实验原理,涉及实验操作、盐类水解、物质的性质检验及反应原理的探究,综合性较强,但基础性知识偏多,难度不大,离子方程式的书写错误率可能偏高点.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验淀粉是否水解 | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热沸腾 |
| D | 证明SO2有漂白性 | 将SO2通入酸性高锰酸钾溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应研发新型高效催化剂以提高合成氨工业中氨的产率 | |
| B. | 糖尿病患者不能食用含糖类的物质 | |
| C. | 空气中NO和NO,等氮氧化物含量过高可导致光化学烟雾或酸雨的形成 | |
| D. | “84”消毒液与漂白粉溶液的有效成分均是Ca( ClO)2,均具有消毒杀菌能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z<Y | B. | 非金属性:X>Y | ||
| C. | 简单气态氢化物的热稳定性:Y>X | D. | W2Y2中含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
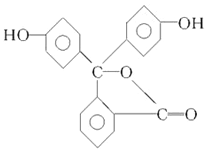
| A. | 酚酞分子中含有两种官能团 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 酚酞属于芳香烃 | |
| D. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )| A. | 1 mol X在一定条件下最多与8 mol H2加成 | |
| B. | 1 mol X在一定条件下最多能与2 mol NaOH反应 | |
| C. | X中有二种含氧官能团,酸性条件下水解产物中也有二种含氧官能团 | |
| D. | X分子式为C16H12O4,和乙醇发生反应生成分子式为C18H18O5的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 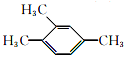 1,2,4-三甲苯 1,2,4-三甲苯 | B. |  2,2,4,4一四甲基戊烷 2,2,4,4一四甲基戊烷 | ||
| C. | 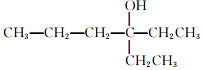 1,1-二乙基-1-丁醇 1,1-二乙基-1-丁醇 | D. |  1,3--溴丙烷 1,3--溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4C1固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应 | |
| B. | CO(g)的燃烧热是-283.0 KJ/mol,则 2CO2(g)═2CO(g)+O2(g)的反应热 为△H=+566.0 KJ/mol | |
| C. | 含1 mol Ba(OH)2的溶液和含1 mol H2SO4的溶液反应放出的热量是中和热 | |
| D. | 1 mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com