
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下: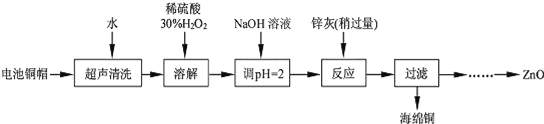
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2 反应的离子反应方程式______________________;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I﹣═2CuI(白色)↓+I2 2S2O32﹣+I2═2I﹣+S4O62﹣
①滴定选用的指示剂为______________,滴定终点观察到的现象为_______________________________;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为__,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会__(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2]=2.0×10﹣20,计算沉淀生成后溶液中c(Cu2+)=__mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2﹣。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0molL﹣1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0molL﹣1HNO3、1.0molL﹣1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②加入适量的1.0molL﹣1NaOH调节pH,产生沉淀;③过滤;
④______________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
【答案】 Cu+H2O2+2H+=Cu2++2H2O 淀粉溶液 蓝色褪去 80.99% 偏高 2×10﹣10 向滤液中滴加1.0molL﹣1NaOH,调节溶液8.9≤pH≤11,使Zn2+沉淀完全
【解析】(1)因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的离子方程式为Cu+H2O2+2H+=Cu2++2H2O。
(2)①淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点,故答案为:淀粉溶液,蓝色褪去;
②舍去实验1数据,求其它三组实验数据平均值为25.31mL,由2Cu2++4I﹣═2CuI(白色)↓+I2 2S2O32﹣+I2═2I﹣+S4O62﹣得到关系式:2Cu2+——I2——2S2O32﹣,
n(Cu2+)=n(S2O32﹣)=25.31mL×10﹣3×0.1000mol/L,电池铜帽中Cu的质量分数为25.31mL×10﹣3×0.1000mol/L×5×64g/mol/1.0g=80.99%。若留有H2O2,加入KI后,会有以下反应:H2O2+2I-+2H+=I2+2H2O,误当成2Cu2++4I-=2CuI(白色)↓+I2生成的碘,使测定结果偏高,故答案为:偏高;
(3)向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,反应后溶液中剩余c(OH—)=1.0×10-5,KSP[Cu(OH)2]=2.0×10﹣20=c(Cu2+)×c2(OH—),c(Cu2+)=2×10﹣10 。
(4)①向滤液中加入30%H2O2,使其充分反应,目的使Fe2+转化完全为Fe3+,滴加NaOH溶液,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,向滤液中滴加1.0molL-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全,900℃煅烧,制得氧化锌。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计).其中能表示等质量的氢气与氦气的是( )
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对以下科学家的发明发现,分析不合理的是( )
A.屠呦呦研究小组发现抗疟新药青蒿素,帮助很多人摆脱了疟疾的威胁
B.侯德榜制碱法,最终制得纯碱的化学式为:NaHCO3
C.阿伏加德罗提出分子学说,使人们对物质结构的认识发展到一个新的阶段
D.门捷列夫发现元素周期律,使化学的研究变得有规律可循
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A. Na+、K+、HCO3-、NO3- B. Mg2+、SO42-、Al3+、NO3-
C. Na+、Ca2+、 NO3-、CO32- D. K+、MnO4-、CH3COO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi![]() LixV2O5。下列说法合理的是( )
LixV2O5。下列说法合理的是( )
A. 电池在放电时,Li+向负极移动
B. 锂在放电时作正极,充电时作阳极
C. 该电池充电时阳极的反应为LixV2O5 - xe- =V2O5 + xLi+
D. V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2020年抗击新冠肺炎的战役中,化学物质发挥了重要作用。下列说法正确的是( )
A.医用消毒酒精中乙醇的体积分数为95%
B.生产医用防护口罩的原料聚丙烯纤维属于纯净物
C.抗病毒疫苗冷藏存放的目的之一是避免蛋白质变性
D.84消毒液可作为环境消毒剂,其有效成分为次氯酸钙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com