25℃时,有pH=12 的NaOH溶液 100mL,欲将其pH变为11,可分别采取下列四种措施(溶液混合时忽略体积变化)
(1)若加入水,则应加入的体积是______ mL;
(2)若加入pH=10的NaOH溶液,则应加入的体积是______mL;
(3)若加入pH=2的HCl溶液,则应加入的体积是______ mL;
(4)若加入0.01mol/L的CH3COOH溶液,则应加入的体积在______范围之间.
【答案】
分析:(1)先根据溶液的pH计算氢氧根离子浓度,再根据C
1V
1=C
2(V
1+V
2)计算加入的水体积;
(2)先根据溶液的pH计算氢氧根离子浓度,再根据C
1V
1+C
2V
2=C
3(V
1+V
2)计算加入的氢氧化钠溶液体积;
(3)先计算混合溶液中氢氧根离子浓度,再根据C(OH
-)=
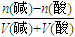
;
(4)假设为强酸,计算需要加入酸的体积,实际上醋酸是弱酸,加入的体积应该稍微小于此值.
解答:解:(1)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V
2,C
1V
1=C
2(V
1+V
2)=0.01mol/L×0.1L=(0.1+V
2)L,V
2=
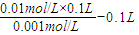
=0.9L=900mL,故答案为:900;
(2)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,
设加入pH=10的NaOH溶液体积是V
2,C
1V
1+C
2V
2=C
3(V
1+V
2)=0.01mol/L×0.1L+0.0001mol/L×V
2=0.001mol/L(0.1+V
2),V
2=1L=1000mL,故答案为:1000;
(3)pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,C(OH
-)=
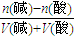
=
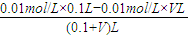
=0.001mol/L,v=81.8mL,
故答案为:81.8;
(4)假设加入醋酸是强酸,根据(3)知,加入的醋酸应该是81.8mL,但CH
3COOH为弱酸,加入81.8 mL后溶液pH<11,故加入的CH
3COOH应小于81.8 mL而大于0,
故答案为:0<V<81.8 mL.
点评:本题考查溶液pH的简单计算,难点(4)题计算醋酸溶液的体积,利用假设法进行分析解答即可,难度较大.

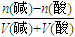 ;
;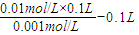 =0.9L=900mL,故答案为:900;
=0.9L=900mL,故答案为:900;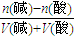 =
=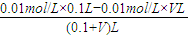 =0.001mol/L,v=81.8mL,
=0.001mol/L,v=81.8mL,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案