
【题目】叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
A. NaN3中只含有离子键
B. 1 mol NaN3完全分解最多可以产生33.6L N2
C. 当有4.2g N2生成时,转移电子数约为6.02×1022
D. 常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项
【答案】C
【解析】
A.该化合物是离子化合物,含有离子键;N3-中还存在非极性共价键,A错误;
B.没给出气体所处状态,因此无法确定放出气体的体积,B错误;
C.4.2 gN2的物质的量是n(N2)=4.2g÷28g/mol=0.15mol,根据分解反应方程式2NaN3 ![]() 2Na+3N2↑可知,每有3molN2生成,转移2mol电子,则有0.15molN2生成时,即有0.1 mol电子转移,故转移电子数约为6.02×1023,C正确;
2Na+3N2↑可知,每有3molN2生成,转移2mol电子,则有0.15molN2生成时,即有0.1 mol电子转移,故转移电子数约为6.02×1023,C正确;
D.由信息知NaN3化学性质不稳定,遇高热或剧烈震动能发生强烈爆炸,所以应在外包装盒上注明低温保存,不能剧烈震动,小心搬移等,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因创造性地研制出抗疟新药青蒿素和双氢青蒿素(对疟原虫有100%的抑制率)而获2015年诺贝尔医学奖。如图为青蒿素的键线式,以下关于青蒿素的说法错误的是
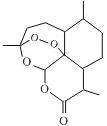
A. 含有酯基,可水解
B. 含有过氧键,有较强氧化性,且不够稳定
C. 青蒿素的化学式C15 H24O5
D. 在水中溶解度不大,易溶于有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
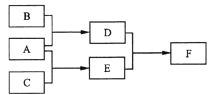
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对沉淀溶解平衡的描述正确的是( )
A.电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的各离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列微粒的电子式:NaOH__________;CS2_________;Na2S_________NH3__________;NH4H________;
(2)用电子式表示下列物质的形成过程MgCl2______________________
(3)现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl①只由离子键构成的物质是________________。
②只由极性键构成的物质是_______________。
③由极性键和非极性键构成的物质是________________。
④由离子键和极性键构成的物质是________________。
⑤由离子键和非极性键构成的物质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。工业水合肼法制备叠氮化钠的工艺流程如图所示:

已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | 97 | 64.7 | 与水互溶 |
水合肼 (N2H4H2O) | 51.7 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | 17 | 12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为_________________________;步骤Ⅱ中生成NaN3的化学方程式为______________________。
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):

①仪器a的名称为____________,作用是_________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是____________。(合理给分)
③图中X处连接的最合适装置应为下图中的_________。

(3)步骤Ⅱ中制备叠氮化钠的操作是_______;步骤Ⅲ中溶液A进行蒸馏的合理操作顺序是___________。(填序号)①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用_______洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是__________。下列操作合理的是______。
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期。下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物。下列分析正确的是
A. Y的氢化物在常温下是液体
B. 与Y同周期氢化物中D最稳定
C. Z的含氧酸均为强酸
D. F含离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法正确的是
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富,仅次于铁
D.工业上通常用钠与铝盐溶液反应来制备铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com