
| A. | CH3CH2CH3 | B. | CH3CH2CH2CH3 | C. | CH3COCH2CH3 | D. | 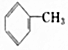 |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

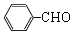 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2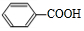 .
. +
+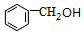 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$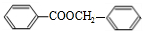 +H2O.
+H2O.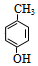 .
.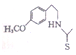 也能发生类似反应④的环化反应,VII的环化产物的结构简式
也能发生类似反应④的环化反应,VII的环化产物的结构简式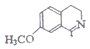 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
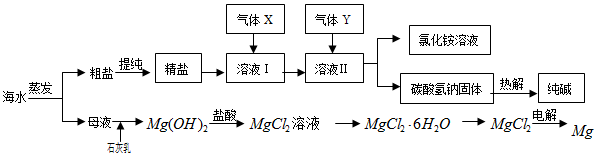
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
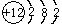 ;
;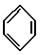 ,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
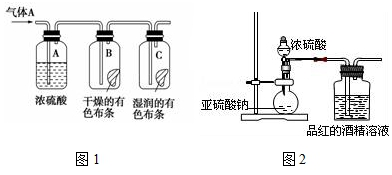
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com