
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的密度之比为 1:1 | B. | 它们的分子数目之比是 1:1 | ||
| C. | 它们的体积之比是 1:1 | D. | 它们的氧原子数目之比为 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙中都是铝过量 | B. | 甲中铝不足、乙中铝过量 | ||
| C. | 甲中酸过量、乙中铝过量 | D. | 甲中酸过量、乙中铝过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
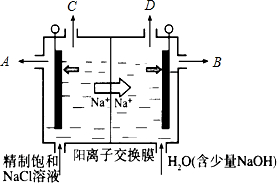 二氧化氯(ClO2)正逐步代替Cl2成为公认的高效、广谱、安全的水处理剂.当自来水厂用ClO2处理后水中含ClO2在0.1~0.8mg•L-1之间时,即达到合格标准.
二氧化氯(ClO2)正逐步代替Cl2成为公认的高效、广谱、安全的水处理剂.当自来水厂用ClO2处理后水中含ClO2在0.1~0.8mg•L-1之间时,即达到合格标准.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| B. | 碱金属Cs与水反应时增大水的用量 | |
| C. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| D. | Al与盐酸反应,加几滴氯化铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com