
| ||
| 1 |
| 2 |
| a+b |
| 2 |
| a+b |
| 2 |
| a+b |
| 2 |
| 1 |
| 2 |
| a+b |
| 2 |
| a+b |
| 4 |
| 1 |
| 2 |
| a-b |
| 2 |
| a+b |
| 4 |
| a-b |
| 2 |


科目:高中化学 来源: 题型:
| A、可以用酸性高锰酸钾溶液或溴水区分乙烷和乙烯气体 |
| B、乙烯中含有SO2,将其通入装有KMnO4溶液的洗气瓶中进行洗气 |
| C、除去苯中的少量苯酚杂质的通常方法是加NaOH溶液振荡后,静置分液 |
| D、乙烷中混有乙烯,可以将混合气体依次通过盛有溴水、氢氧化钠和浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
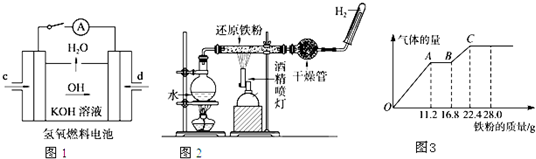
| A、石墨上发生氧化反应 |
| B、电解质溶液中的OH-移向正极 |
| C、电子由石墨通过外电路流向锌片 |
| D、该电池使用中无需补充氢氧化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl |
| B、NaOH |
| C、Na2SO4 |
| D、H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com