
氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
|
| A. | 若管道漏气遇氨就会产生白烟 |
|
| B. | 该反应利用了Cl2的强氧化性 |
|
| C. | 该反应属于复分解反应 |
|
| D. | 生成1mol N2有6mol电子转移 |
考点:
氯气的化学性质.
专题:
卤族元素.
分析:
如果管道漏气,则发生反应3Cl2+2NH3=N2+6HCl,生成HCl气体继续与氨气反应生成氯化铵,现象为有白烟生成,反应中氯气表现出氧化性,根据化合价的变化可知生成1molN2有6mol电子转移.
解答:
解:A、如果管道漏气,发生反应3Cl2+2NH3=N2+6HCl,反应生成HCl,HCl与NH3反应生成NH4Cl,现象为有白烟生成,故A正确;
B、在3Cl2+2NH3=N2+6HCl反应中,Cl元素的化合价由0价降低为﹣1价,氯气表现出氧化性,故B正确;
C、反应中元素化合价发生变化,为氧化还原反应,故C错误;
D、在3Cl2+2NH3=N2+6HCl反应中,N元素的化合价由﹣3价升高到0价,则生成1molN2有6mol电子转移,故D正确.
故选C.
点评:
本题考查氯气的化学性质和氧化还原反应有关知识,题目难度不大,注意氯气化学性质以及氧化还原反应有关反应的概念的理解.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观实际.下列各说法中正确的是( )
|
| A. | 根据化合价Fe3O4可表示为FeO•Fe2O3,则Pb3O4也可表示为PbO•Pb2O3 |
|
| B. | CaC2能水解:CaC2+2H2O=Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O=4Al(OH)3+3CH4↑ |
|
| C. | Cl2与Fe加热生成FeCl3,则I2与Fe加热生成FeI3 |
|
| D. | SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列各组物质 ①O2和O3 ②12C和14C ③CH3CH2CH2CH3和(CH3)2CHCH3
④干冰和SiC ⑤金刚石和SiO2
它们的晶体属于分子晶体的是 ,互为同位素的是 ,属于原子晶体的是 .
(2)配离子[TiCl(H2O)5]2+的中心离子的符号为 ,配位数为 .
(3)写出下列方程式
①甲酸(HCOOH)与甲醇(CH3OH)在浓硫酸加热条件下发生酯化反应的化学方程式
②苯与液溴在溴化铁催化剂下反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)⇌2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示.
压强/MPa
体积分数/%
温度/℃ 1.0 2.0 3.0
810 54.0 a b
915 c 75.0 d
1000 e f 83.0
①b<f ②915℃、2.0MPa时E的转化率为60%
③该反应的△S>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有()
A. 4个 B. 3个 C. 2个 D. 1个
查看答案和解析>>
科目:高中化学 来源: 题型:
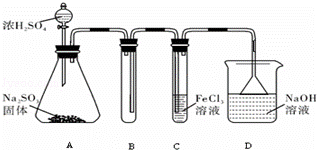
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 ,操作中不需要的仪器有 (填字母).
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时C中观察到的现象为 ,
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成取 ;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣.该做法 (填“合理”或“不合理”),理由是 .
(4)D装置中倒置漏斗的作用是 .
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有 (填入正确选项前的字母).
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原子序数11~17的元素,自钠到氯,电子层数相同,最外层电子数从 增加到 ,随着核电荷数依次递增,原子半径依次 ,核对外层电子的引力逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此,金属性逐渐 ,非金属性逐渐 .
(2)元素金属性的强弱,可以从它的单质与水或酸的反应置换氢的 程度,以及它的最高价氧化物的水化物的 强弱来判断.元素非金属性的强弱,可以从它的最高价氧化物的水化物的 强弱,或它的单质跟氢气生成气态氢化物的 及氢化物的 来判断.
(3)元素的性质随着原子序数的递增而呈 的变化,这个规律叫做元素周期律.
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H7Cl的有机物,其结构不可能是( )
|
| A. | 只含有1个双键的直链有机物 |
|
| B. | 含2个双键的直链有机物 |
|
| C. | 含1个双键的环状有机物 |
|
| D. | 含一个三键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
食品香精菠萝酯的生产路线(反应条件略去)如图所示,下列叙述错误的是( )
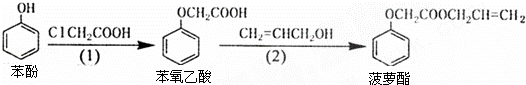
A. 步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B. 步骤(2)产物中残留的烯丙醇可用溴水检验
C. 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D. 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com