
仔细阅读给CuSO4·5H2O晶体加热过程中依次发生的如下反应:
CuSO4·5H2O![]() CuSO4+5H2O,CuSO4
CuSO4+5H2O,CuSO4![]() CuO+SO3
CuO+SO3
4CuO![]() 2Cu2O+O2,2SO3
2Cu2O+O2,2SO3![]() 2SO2+O2
2SO2+O2
今取25.0 g CuSO4·5H2O晶体加热,使之均匀、缓慢升温至1000 ℃,并恒温1 h。请完成下列问题:
(1)最终所得固体的颜色为____________,质量为____________ g。
(2)不考虑实验带来的误差,在反应条件下,反应后的除去水后的气态产物的物质的量可能为____________(填写下列选项)。
A.0 B.0.1 mol C.大于0.1 mol
(3)(2)问中除上述三个选项外,你认为更准确的范围应该是什么?并予以说明。
(4)如果某同学做此实验时,最后固体质量为7.6 g,试通过计算判断该固体物质的组成,其物质的量各是多少?
(1)红(或砖红)色 7.2 (2)C
(3)CuO分解生成0.025 mol O2,SO3分解是可逆反应,故SO3分解反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol
(4)剩余固体7.6 g,介于7.2—8.0 g之间,故为CuO和Cu2O混合物。
n(Cu)=n(CuSO4·5H2O)=0.1 mol
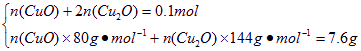
n(CuO)=0.05 mol
n(Cu2O)=0.025 mol
由题给信息知,反应最终固体产物是红色的Cu2O,并由Cu元素守恒得m(Cu2O)= ![]() n(CuSO4·5H2O)×M(Cu2O)=
n(CuSO4·5H2O)×M(Cu2O)=![]() ×0.1 mol×144 g·mol-1=7.2 g。若不考虑误差,0.1 mol CuSO4分解产生SO3和CuO各0.1 mol,CuO又分解生成0.025 mol O2,由于SO3分解是可逆反应,反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol。由于0.1 mol CuSO4·5H2O高温分解可得0.1 mol CuO,即质量为8.0 g,CuO继续分解最终可得7.2 g Cu2O。如果最后固体质量为7.6 g,介于7.2 g—8.0 g之间,说明是CuO和Cu2O的混合物,可依据Cu元素守恒列方程组求解其物质的量。
×0.1 mol×144 g·mol-1=7.2 g。若不考虑误差,0.1 mol CuSO4分解产生SO3和CuO各0.1 mol,CuO又分解生成0.025 mol O2,由于SO3分解是可逆反应,反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol。由于0.1 mol CuSO4·5H2O高温分解可得0.1 mol CuO,即质量为8.0 g,CuO继续分解最终可得7.2 g Cu2O。如果最后固体质量为7.6 g,介于7.2 g—8.0 g之间,说明是CuO和Cu2O的混合物,可依据Cu元素守恒列方程组求解其物质的量。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:阅读理解
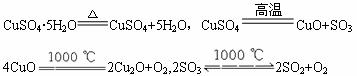
今取25.0 g CuSO4·5H2O晶体加热,使之均匀、缓慢升温至1000 ℃,并恒温1 h。请完成下列问题:
(1)最终所得固体的颜色为____________,质量为____________ g。
(2)不考虑实验带来的误差,在反应条件下,反应后的除去水后的气态产物的物质的量可能为____________(填写下列选项)。
A.0 B.0.1 mol C.大于0.1 mol
(3)(2)问中除上述三个选项外,你认为更准确的范围应该是什么?并予以说明。
(4)如果某同学做此实验时,最后固体质量为7.6 g,试通过计算判断该固体物质的组成,其物质的量各是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com